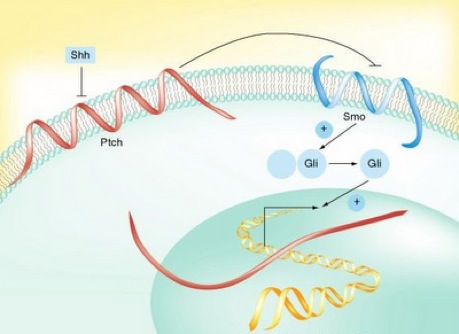
La vía de transducción de señales Hedgehog (Hh) consta de varios componentes: el receptor de membrana Ptch1 («parchado») y la proteína transmembrana SMO (smothered homologue), así como los efectores Gli que son factores de transcripción. En ausencia de ligando el Ptch1 impide que el SMO libere los Gli. La resultante final es silencio transcripcional. Cuando Shh (sonic hedgehog) se liga al Ptch1 se libera el SMO que a su vez activa los Gli. El resultado final es incremento en la transcripción, con proliferación celular (ver figura). La vía Hh es importante durante la embriogénesis.
La vía del Hedgehog es fundamental en el carcinoma basocelular (CBC), con mutaciones activantes descritas en el Ptch1 y SMO. De hecho, en el Síndrome de Gorlin (Síndrome nevoide basocelular, autosómico dominante, caracterizado por la formación de carcinomas basocelulares durante la pubertad) la mutación está en el gen Ptch1. Inhibidores de la vía Hh como el Vismodegib (antes conocido como GDC-0449) han demostrado actividad en estudios fase I con una respuesta del 55% en 33 pacientes con CBC avanzado.
A principios de febrero (2012), la Administración de Alimentos y Medicamentos (FDA) de los EE. UU. aprobó vismodegib (Erivedge) para tratar adultos con carcinoma de células basales , el tipo de cáncer de piel más común. El fármaco está dirigido a pacientes con cáncer de células basales localmente avanzado que no son candidatos para cirugía ni radiación, y a pacientes en quienes el cáncer se ha metastatizado .
Vismodegib es el primer fármaco aprobado por la FDA para el carcinoma de células basales metastásico, y fue evaluado según el programa de revisión prioritaria de la FDA, el cual proporciona una evaluación acelerada de 6 meses de aquellos fármacos que pueden ofrecer importantes avances en el área de tratamiento.
El fármaco es una tableta (150 mg) que se toma una vez al día e inhibe la vía de Hedgehog, la cual es una vía molecular que se encuentra activa en la mayoría de los cánceres de células basales y solo en unos cuantos tejidos normales, como los folículos pilosos.
La eficacia y la seguridad del fármaco vismodegib fueron evaluadas en un estudio clínico multicéntrico de un solo grupo de 104 pacientes con carcinoma de células basales localmente avanzado o metastásico. El criterio de valoración primario del estudio fue el índice de respuesta objetiva , que se pudiera evaluar en 96 pacientes. El treinta por ciento de los pacientes con enfermedad metastásica presentaron una respuesta parcial , y el 43 por ciento de los pacientes con enfermedad localmente avanzada presentaron una respuesta completa o parcial.
Los efectos secundarios más comunes fueron espasmos musculares, pérdida de cabello, pérdida de peso, náuseas, diarrea, cansancio, alteración del sentido del gusto, disminución del apetito, estreñimiento, vómitos y pérdida de la sensación gustativa en la lengua.
Vismodegib fue aprobado con un recuadro de advertencia para alertar a los pacientes y profesionales de la salud sobre los riesgos de muerte fetal o graves defectos de nacimiento. Se debe verificar si la paciente está embarazada antes de iniciar el tratamiento. Se les debe advertir a los pacientes sobre estos riesgos y la necesidad de que tanto el hombre como la mujer usen métodos anticonceptivos.
Los estudios en fase II incluyeron 104 pacientes con CBC localmente avanzado (LaBCC, n=71) o metastásico (mCBC, n=33) con enfermedad evaluable por RECIST. Se definía como LaCBC aquellas lesiones que no eran susceptibles de resección quirúrgica o que la cirugía causaría gran deformidad. Los pacientes recibieron Vismodegib por vía oral 150 miligramos cada día. El desenlace principal era la tasa de respuesta (ORR) evaluada en forma independiente (IRF). Se encontró una ORR en LaCBC del 43% (intervalo de confianza del 95% de 31-56%) y del 30% en mCBC (intervalo de confianza del 95% de 16-48%). El Vismodegib fue bien tolerado con efectos adversos comunes (mayor de 30%) que consistieron en espasmos musculares, alopecia, disgeusia, pérdida de peso y fatiga. No hubo fallecimientos causados por el medicamento. Estos resultados corroboran la utilidad del vismodegib en el manejo de CBC avanzado.
El 7 de junio del presente año la revista The New England Journal of Medicine(N Engl J Med 2012, 366:2180-2188) publica los resultados de un ensayo con Vismodegib en pacientes con Síndrome nevoide basocelular (Gorlin Goltz). El estudio fue doble ciego, aleatorizado y placebo controlado con pacientes de 3 Centros Clínicos (EEUU) desde septiembre 2009 a enero 2011. De los 41 pacientes seguidos por 8 meses en promedio (rango, 1 a 15) el índice de CBC elegibles para nuevas cirugías fue mas bajo con vismodegib que con placebo (2 vs 29, P <0.001). Ningún tumor progresó durante el tratamiento, en algunos pacientes hubo remisión clínica, MAS DE LA MITAD DE LOS PACIENTES ABANDONARON EL ESTUDIO POR LOS EFECTOS ADVERSOS.
Anexo la ficha técnica del producto aprobado a Laboratorios Roche por la FDA:
[dl url=»https://piel-l.org/blog/wp-content/uploads//2012/06/Ficha-tecnica-Vismodegib-FDA-2012.pdf» title=»DESCARGAR» desc=»Ficha tecnica Vismodegib» type=»pdf» align=»left»] PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998


Excelente! puesta al día de los avances en biología molecular y su utilidad en terapéutica dermatológica.