La fertilización y posterior desarrollo embrionario en un organismo, como por ej. en humanos, es un proceso complejo y poco conocido en términos embriológicos, interacciones celulares, moleculares, etc. En años recientes han sido evidente los progresos en la investigación de la inducción de células madres pluripotentes (iPSC: siglas en ingles de Induced Pluripotent Stem Cell), lo cual ha abierto un sinnúmero de oportunidades en cuanto a su aplicabilidad en medicina, tales como medicina regenerativa y medicina reproductiva, entre otras. Esta ultima, en la producción de gametos artificiales (GA) a partir de células progenitoras (células madres) o células somáticas, tanto en humano como en algunos otros animales, p. ej. ratón.1 Dicha investigación abre en la sociedad una discusión bioética importante en cuanto al uso de estos GA en medicina reproductiva, ya que podrían a futuro ayudar a parejas con problemas de infertilidad a generar prole, al igual que potencialmente permitiría la concepción de hijos genéticamente relacionados en parejas de un mismo sexo.
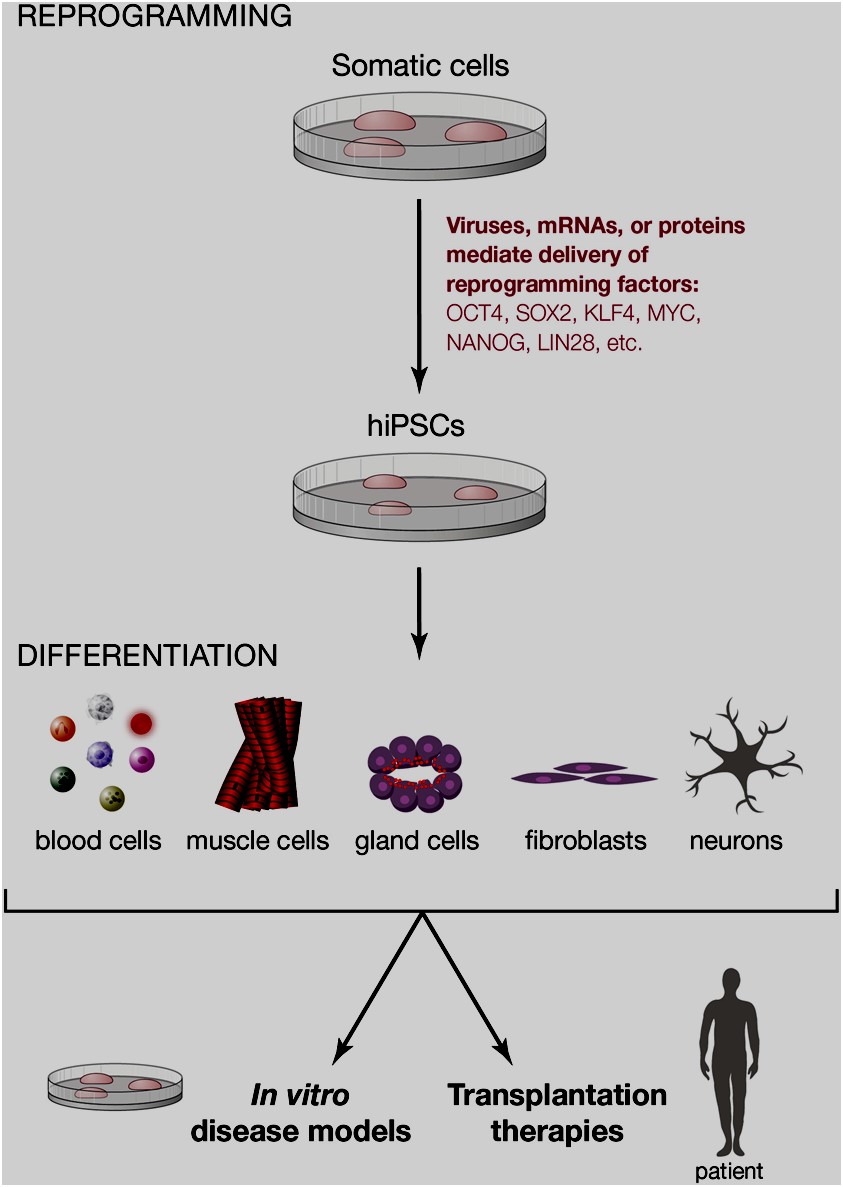
Las células madres constituyen los elementos fundamentales a partir de los cuales pueden diferenciarse diversos tipos de células de un organismo. De igual manera, bajo condiciones apropiadas, in vitro, tienen la pluripotencia de diferenciarse en cualquier tipo de célula somática. Estudios previos demuestran que células diferenciadas pueden generar células madres a través de un proceso de reprogramación (ver figura).3
Estrategias eficientes a partir de células madres generadas mediante técnicas de reprogramación de células de piel humana, al igual que de células madres embrionarias (CME) generadas de ratones, han sido determinantes en la producción de cultivos GA y de su posterior transformación a estructuras parecidas a embriones.3,4 Recientemente, se ha demostrado in vitro el proceso completo de oogénesis en ratón. A partir de CME derivadas de dos fuentes, fibroblastos embrionarios y fibroblastos obtenidos de la cola de ratones adultos, se generaron en cultivo oocitos maduros, demostrándose su funcionabilidad mediante la producción de una prole viable y fértil; luego de fertilización in vitro e implante en ratones hembras, la prole resultante produjo a su vez una segunda generación igualmente fértil.5
La producción de células reproductivas humanas resulta muy interesante, a pesar de los problemas bioéticos que se plantean. En general, la infertilidad en humanos es un desorden complejo que afecta aproximadamente un 15% de parejas en edad reproductiva; una de sus causas principales parece estar relacionada con anormalidades cromosómicas, las cuales producen alteraciones en el proceso de meiosis y en el desarrollo de células germinales. La inducción de células iPSC a partir de células de la piel de pacientes masculinos fértiles normales o con azoospermia, una condición que merma en individuos la producción de espermatozoides, demostró que iPSC provenientes de pacientes con azoospermia, luego de xenotransplantación en el sistema reproductivo de ratón, son capaces de generar potenciales células parecidas a células germinales en una baja proporción en comparación a individuos normales.4 Por otro lado, la evaluación de iPSC producidas de eritroblastos de pacientes con azoospermia demostró por primera vez que alteraciones cromosómicas particulares efectivamente afectan el proceso de espermatogénesis.6
Estas evidencias sugieren que en un futuro cercano estaremos en la capacidad de conocer en forma detallada los intríngulis celulares, moleculares, e interacciones del entorno celular, de los eventos inmediatos al proceso de fertilización. Por otro lado, nos deja una puerta abierta a la generación de embriones viables producto de una reproducción sintética mediante el uso de GA.
Aparte de los problemas bioéticos, uno de los principales problemas en humanos es la determinación de la funcionabilidad de estos GA, en otras palabras la capacidad de producir progenie viable y sana a partir de ellos. De ser posible, la selección y evaluación de embriones sanos estaría asociada a otras tecnologías, como por ejemplo la edición del material genético a fin de corregir y evitar desordenes hereditarios, tales como aquellos genes relacionados con enfermedades particulares. Estaremos pendiente de los avances científicos en el área de reproducción humana.
Referencias
- Regalado A. 2017. A New way to reproduce. MIT Technology Review August https://www.technologyreview.com/s/608452/a-new-way-to-reproduce/
- Hendricks S. et al. 2015. Artificial gametes: a systematic review of biological progress towards clinical application. Human Reproduction Update. 21:285–296 https://doi.org/10.1093/humupd/dmv001
- Harrison S.E. et al. 2017. Assembly of embryonic and extra-embryonic stem cells to mimic embryogenesis in vitro. Science doi: 10.1126/science.aa11810 http://science.sciencemag.org/content/early/2017/03/01/science.aal1810
- Ramathal C. et al. 2014. Fate of iPSCs derived from azoospermic and fertile men following xenotransplantation to murine seminiferous tubules. Cell Report 7:1284-97 http://www.cell.com/cell-reports/pdf/S2211-1247(14)00264-2.pdf
- Hikabe O. et al. 2016. Reconstitution in vitro of the entire cycle of the mouse female germ line. Nature 539:299–303. doi. 10.1038/nature2010 https://www.nature.com/nature/journal/v539/n7628/pdf/nature20104.pdf
- Mouka A. et al. 2017. Induced pluripotent stem cell generation from a man carrying a complex chromosomal rearrangement as a genetic model for infertility studies. Nature Scientific Reports doi. 10.1038/srep39760. ScientificRepoRts| 7:39760.
Imagen tomada de Dirk Hockemeyer, Rudolf Jaenisch. 2016. Cell Stem Cell. 18:573-586. DOI: 10.1016/j.stem.2016.04.013
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998