El almacenamiento y accesibilidad del material genético (DNA) en un volumen tan pequeño como lo es el núcleo de una célula eucariota, está relacionado con distintos niveles de compactación o empaquetamiento. Las proteínas básicas llamadas histonas juegan un papel fundamental en la formación de los nucleosomas, primer nivel de compactación, mientras que la formación del cromosoma en el proceso de división celular representa el máximo nivel de empaquetamiento.1 Cada cromosoma contiene una hebra lineal de DNA de doble cadena, cuyos extremos son de cadena sencilla formados por secuencias de nucleótidos repetitivas ricas en T (timina) y G (guanina) y altamente conservadas en la mayoría de los organismos eucariotes. Las regiones terminales o extremos de los cromosomas son los llamados telomeros, que no es más que un complejo núcleo-proteico determinante de la estabilidad cromosómica. Una de las proteínas asociadas a los telomeros es la enzima telomerasa (TERT), responsable del mantenimiento de la longitud de los telomeros en el proceso de replicación del DNA de cadena sencilla (cataliza la síntesis de la secuencia final del telómero), el cual está asociado a un pequeño RNA molde (~11 nucleótidos).2
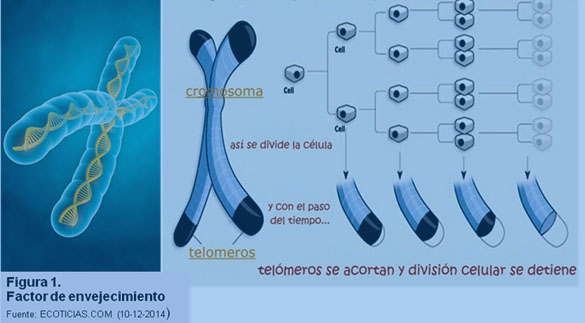
El tamaño de las secuencias teloméricas terminales, varía dependiendo de diversos procesos biológicos tales como el envejecimiento celular, muerte celular y cáncer. La telomerasa muestra gran actividad en gametos, células madre y células tumorales que ayuda a prevenir el acortamiento de los telómeros, así la telomerasa actúa como una enzima anti-envejecimiento. Sin embargo, en células somáticas humanas el potencial de proliferación es limitado, alcanzando la senescencia luego de varias divisiones celulares debido, entre otros factores, al acortamiento que sufren los telómeros por pérdidas progresivas de sus secuencias repetitivas durante las sucesivas divisiones celulares, generando inestabilidad cromosómica (Fig. 1). En otras palabras, el envejecimiento está asociado a la reducción del tamaño de los telomeros.
Las funciones de los telómeros y la telomerasa en el envejecimiento celular fueron descubiertos por primera vez en los años 1980 y 1990 por los pioneros Elizabeth Blackburn, Carol Greider y Jack Szostak, que todos compartieron el Premio Nobel de Medicina en el 2009 por «el descubrimiento de cómo los cromosomas están protegidos por los telómeros y la enzima telomerasa «.
En el caso particular de células neoplásicas, la actividad de la telomerasa se mantiene impidiendo la reducción de tamaño de las regiones teloméricas y por ende permitiendo la división celular por tiempo indefinido, un buen ejemplo de ello es la división de las células HeLa.3
Un planteamiento interesante sobre aspectos fisiológicos fundamentales de los telomeros sería el siguiente: si la telomerasa hace a las células cancerosas inmortal, ¿no podía evitarse el envejecimiento de las células normales? ¿Podríamos extender la vida útil de preservar o restaurar la longitud de los telómeros con la telomerasa (terapia genética)? De ser el caso, ¿habría que aumentar el riesgo de contraer cáncer?.4,5,6
En los últimos años, las investigaciones en cáncer, envejecimiento y medicina regenerativa han alcanzado un gran avance, al igual que el desarrollo y caracterización de modelos animales que han permitido entender los mecanismos moleculares involucrados en estos procesos. La investigación en telómeros y el desarrollo de terapias orientadas a prevenir el acortamiento de los mismos, en una potencial prevención de enfermedades degenerativas, o bien para evitar la progresión tumoral, ha alcanzado un gran auge. 6,7 En este sentido, algunas compañías se han propuesto como objetivo desarrollar aplicación de terapias avanzadas que reviertan el envejecimiento celular y tisular. Esperaremos a ver que nos depara la ciencia en un futuro cercano en cuanto una potencial terapia anti envejecimiento y control en la multiplicación de células neoplásicas.
Alexis Mendoza-León, PhD. Email: [email protected]
Referencias
- Mendoza-León A. La maravilla de una macromolécula: el DNA. http://piel.org/blog/31213
- Gómez y col. 2014. Telomerasa y telómero: su estructura y dinámica en salud y enfermedad Medicina (B. Aires) vol.74 (1). http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0025-76802014000100017
- Noticias de la ciencia. 2013. Solución legal al dilema de la línea celular inmortal de Henrietta Lacks. http://noticiasdelaciencia.com/not/8060/
- Are Telomeres the Key to Aging and Cancer. http://learn.genetics.utah.edu/
- Rahmanto YS y col. 2016. Inactivating ARID1A Tumor Suppressor Enhances TERT Transcription and Maintains Telomere Length in Cancer Cells. http://www.jbc.org/cgi/doi/10.1074/jbc.M115.707612
- Bär C y col. 2016. Telomerase gene therapy rescues telomere length, bone marrow aplasia, and survival in mice with aplastic anemia. 127(14):1770-9. doi: 10.1182/blood-2015-08-667485. http://www.ncbi.nlm.nih.gov/pubmed/26903545
- Grens K. First Data from Anti-Aging Gene Therapy. http://www.the-scientist.com/?articles.view/articleNo/45947/title/First-Data-from-Anti-Aging-Gene-Therapy/
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998