Los avances en el proyecto del genoma humano y el desarrollo tecnológico asociado al mismo, han sido de gran importancia en la identificación de genes y expresiones genéticas relacionadas con enfermedades particulares, el desarrollo de pruebas diagnósticas que puedan detectar la predisposición a tales enfermedades, así como la evaluación en la acción de drogas utilizadas en el tratamiento de enfermedades particulares, en el área dermatológica tenemos como ejemplo cáncer, psoriasis, dermatitis atópicas, entre otras. Igualmente, la información genómica ha sido de utilidad en la implementación de nuevas terapias genéticas como la edición del material genético y el uso de células madres en el reemplazo de tejidos.1
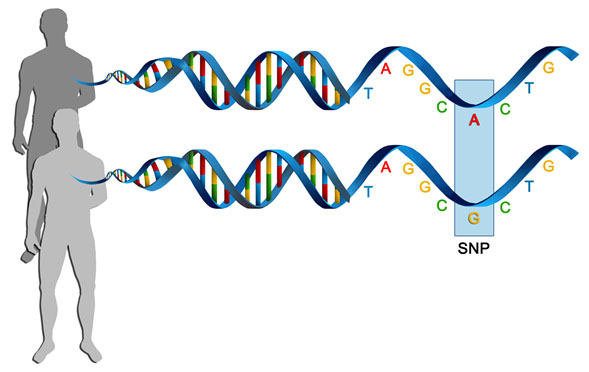
La Farmacogenómica se enfoca en la identificación de variantes genéticas sobre el DNA que afectan la respuesta de un paciente a la acción de algún fármaco, por ej. cambios en la secuencia del DNA que generan alteraciones en la farmacocinética o farmacodinámica de una droga determinada, afectando la sensibilidad farmacológica sobre el tratamiento dirigido al paciente (terapia farmacológica). En principio, tales variantes genéticas en un individuo, son productos de cambios heredables presentes en el material genético de las células germinales parentales, siendo las más comunes los cambios de un solo nucleótido en la secuencia de DNA (SNP: single nucleotide polimorphism, de sus siglas en inglés). Igualmente, muchos de estos cambios pueden presentarse en células somáticas, influyendo de igual forma en la respuesta farmacológica.2,3
Algunos ejemplos en dermatología del uso de la genómica en la evaluación farmacológica están representados por tratamientos en psoriasis y melanomas. 2,4 Varios de los genes que forman parte de la ruta de la proteína quinasa activada por mitógeno (MAPK), han sido relacionados con la progresión de melanomas. Particularmente, pacientes con melanoma metastásico BRAF-V600 son tratados específicamente con el fármaco vemurafenib; dicho melanoma es producto de una mutación en la posición 600 de la secuencia del gen BRAF (gen que codifica para la serin-treonina proteína quinasa), que produce una sustitución del aminoácido ácido glutámico por el aminoácido valina (V600). La efectividad del fármaco disminuye considerablemente o no tiene efecto, en melanomas que no presentan esta mutación y en muchos casos tiene efectos adversos como promover la progresión del melanoma. De esta forma, la identificación previa de dicha mutación en pacientes con melanoma es un marcador determinante para el tratamiento con vemurafenit.2 Algunas otras experiencias relacionadas con la acción de otros fármacos sobre variantes en otros genes relacionados con melanoma, parecen indicar una especificidad genética. Fármacos alternativos han sido evaluados y recientemente combinaciones de algunos de estos fármacos con inmunoterapia han generado resultados promisorios en el tratamiento personalizado de melanomas.5
Algunas de limitaciones de la aplicabilidad clínica de la farmacogenómica existen. Entre otras, podemos citar en primer lugar, la variabilidad en la acción de un fármaco determinado en una enfermedad monogenética por ej. epidermólisis ampollar, respecto a una poligenética como dermatitis atópica o psoriasis. Múltiples variantes pueden afectar el tratamiento farmacológico de una enfermedad, por ej. no es lo mismo una enfermedad generada por variaciones de un gen en particular (monogenética) que aquellas donde más de un gen se encuentra involucrado (poligenética), o cambios epigenéticos, entre otros, que afectan varias expresiones genéticas; en estos casos, se hace necesario un estudio amplio de la dinámica de la red (es) genética de regulación relacionada con la enfermedad y con la falla farmacológica.
Segundo, estudios genómicos entre poblaciones han establecido que la variabilidad genética difiere de acuerdo a sus ancestros, lo cual plantea algunos problemas en el traslado de la farmacogenética entre poblaciones ya que múltiples variantes, de un mismo gen o múltiples genes, pueden estar involucrados en la acción eficiente de una o más drogas, en particular, en poblaciones distintas.6 En este sentido, proyectos como el de la secuenciación de 100.000 genomas de la compañía “Genomic England”, tratan de facilitar la utilización de la información genómica y su transferencia en la identificación de causa (s) de enfermedades particulares, nuevos test de diagnóstico, diseño y evaluación de nuevos tratamientos, así como su utilización en clínica.6,7
El estudio de la variabilidad de genes relacionados con la piel será de gran importancia para obtener marcadores diagnósticos, identificar nuevos blancos terapéuticos de muchas enfermedades de la piel y nuevos fármacos con mejor valor terapéutico, permitiendo así la evaluación más efectiva de reacciones adversas a diversos fármacos. Lo anterior, permitirá en un futuro cercano el manejo de una terapia dermatológica personalizada.
Referencias
- Rizzo AE and Maibach HI. 2012. Personalizing dermatology: The future of genomic expression profiling to individualize dermatologic therapy. J Dermatolog Treat 23:161-167. 10.3109/09546634.2010.535806
- Schweitzer J and Maibach H. 2015. Pharmacogenomics in dermatology: Taking patient treatment to the next level. J Dermatolog Treat 26:94-96. 10.3109/09546634.2013.878447
- Relling MV and Evans WE. 2015. Pharmacogenomics in the clinic. Nature 526:343-350. DOI: 10.1038/nature.15817
- Ovejero-Benito MC et al. 2017. Pharmacogenetics and Pharmacogenomics in moderate-to-severe psoriasis. Am J Clin Dermatol 10.1007/s40257-017-0322-9
- Dorrie J et al. 2018. BRAF and MEK inhibitors influence the function of reprogrammed T cells: Consequences for adoptive T-cell therapy. Int J Mol Sci 19:289. 10.3390/ijms19010289
- Shah RR and Gaedigh A. 2018. Precision medicine: does ethnicity information complement genotype-based prescribing decisions? Ther Adv Drug Saf 9:45-62. DOI. 10.1177/2042098617743393
- Weinshilboum RM and Wang L. 2017. Pharmacogenomic: Precision Medicine and Drug Response. Mayo Clin Proc 92(11):1711-1722. http://dx.doi.org/10.1016/jj.mayocp.2017.09.001
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998