Presentado por Rolando Hernández Pérez (dermatólogo), Carmen J. Bastidas Montilla (dermatólogo), Marisela Acosta Casanova (Anatomopatólogo), Clínica Ntra. Señora del Pilar . Barinas/ Venezuela
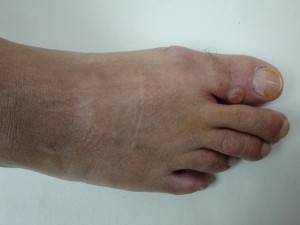
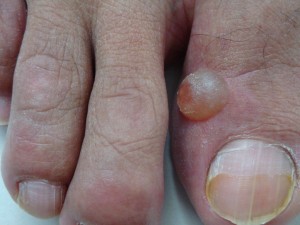
Paciente de 50 años de edad, ingeniero civil, quien consulta por ampolla (bolla) no inflamatoria, contenido claro, no dolorosa, de evolución cíclica, recidivante, crecimiento rápido, localizada en el tercio anterior de la cara dorsal del halux derecho, desde hace seis (6) meses . Refiere que se inició bruscamente y que después de dos día aproximadamente drena sola o el paciente drena al romperla con objeto cortante un liquido aceitosos, viscoso, gelatinosos, amarillento, se vacía y al mes nuevamente aparece la lesión ampollar.
(Favor ver foto Clínica Nº DSC00183.jpg-DSC00184.jpg-DSC00185.jpg-DSC00186.jpg-DSC00187,jpg)
No hay antecedente de diabetes ni de otra patología metabólica.
Hipertensión arterial leve, obesidad exógena en tratamiento. No antecedente de traumatismo ni medicamentos.
Laboratorio convencional dentro de la normalidad
Se extirpó la lesión y se disecaron los márgenes laterales y profundo, el límite profundo era trilobulado y al cortarlo hubo salida de un contenido espeso, viscoso amarillento. Se envío material para anatomía patológica. En el 2º dedo del pié derecho neoformación trinagular, dura al tacto con 4 años de evolución compatible con fibroma.
Histopatología: ampolla intraepidermica, con formación de multiples pseudo espacios quísticos de contenido seroso-proteinaceo. No se acompaña de infiltardo inflamatorio; se observan células adosadas a los espacios quísticos que dan a la luz, compatibles con queratinocitos apoptóticos.
Dermis papilar una marcada dilatación y congestión vascular
(Favor ver imagen histopatológica Nº DSCN4261.jpg-DSCN4262.jpg-DSCN4263.jpg-DSCN4264.jpg-DSCN4265.jpg-DSCN4266.jpg-DSCN4267.jpg)
Cual es su diagnostico?
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998


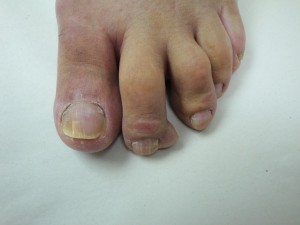








En el 2º dedo del pié derecho neoformación triangular, dura al tacto con 4 años de evolución compatible con fibroma.
Fe de errata: 2º dedo del pié IZQUIERDO, no 2º dedo del pié derecho como aparece escrito.
Gracias
Estimados colegas:
El caso es bravo de bregar.
Dos posibilidades vienen a la mente: (1) Un quiste mixoide digital (mas bien, pseudoquiste) es una. He visto ampollas en esta enfermedad, tanto subepidermicas, como intraepidérmicas y subcorneales, conteniendo mucus. Sin embargo, no las he visto exactamente como la que aparece en tu paciente pero la base de cicatriz debajo de la ampolla sugiere el concomitante de trauma en tales pseudoquistes y en gangliones y por esa combinación de hallazgos me apunto de entrada con este diagnóstico.
Mi problema es que el contenido de la ampolla no parece mucoide histológicamente, aunque si podría ser líquido sinovial propiamente dicho o mucus de origen teno-sinovial degenerativo por la descripción clínica de líquido aceitoso y viscoso. También puede ser que el mucus se haya perdido o lavado en el procesamiento. Sugiero definirlo mejor con un azul alciano o con un frotis si vuelve a derramarse.
La apariencia pseudoendotelial de la epidermis pudiese ser reactiva a la presión del fluído mucoide sobre queratinocitos que degeneran y aparecen apoptóticos. No creo que sea esto idéntico, pero podría estar relacionado a lo que yo he descrito como re-epitelialización inversa en la parte interna de algunas vesículas de varios días de duración y resistentes a la ruptura (de porfiria, por ejemplo) que le daría a la epidermis una doble cara, con capa granulosa mirando hacia afuera y otra, antipódica, mirando hacia adentro (efecto Janus, por el dios romano de dos caras diametralmente opuestas). Ello sería como si la epidermis se regenerara futilmente hacia arriba y hacia abajo desde su mismo techo, cuando la verdadera re-epitelialización viene de anexos eccrinos o foliculares debajo de la cavidad o de la epidermis intacta vecina a la ampolla. [Gonzalez-Serva, Aldo; Munoz-Garcia, Liliana; Gonzalez-Beicos, Aldo. Reverse Reepithelialization of the Janus-Like Blister Roof of Porphyria. American Journal of Dermatopathology. 27(6):531 (Abstract), December 2005]
(2) La otra posibilidad es que se trata de una ampolla llena de linfa, lo que sería un linfocele en sentido amplio, por encima de un linfangioma o de linfangiectasias. Esta idea más extraña se apoyaría en que el fluído no sea mucoide, asi que este punto es crucial de tener claro. En apoyo eventual de esta hipótesis está el aspecto hiperémico, casi celulítico/linfangítico, de la vecindad de la ampolla en la foto clínica. Aun más, los dos tercios distales de la uña del mismo dígito parecen representar una versión leve de «síndrome de la uña amarilla» que puede verse en situaciones de defecto de la vascularidad linfática. Hay ciertos precedentes de ampollas debidas a linfostasis o a linforragia (o lo que yo propondría llamar linfoceles cutáneos) que incluyo en una breve bibliografía más abajo. Estos precedentes incluyen: ampollas en escleroderma, liquen escleroso, sarcoma de Kaposi y hasta en linfangiectasias intestinales repercutiendo a tanta distancia como lo es la piel de la pared abdominal.
En fin, este caso es apretado pero no insoluble. Me inclino más por el quiste mucoide digital pero la otra idea debe ser explorada. ¿Podría ser que una combinación de ambas situaciones, tanto quiste digital como linfangitis secundaria, sea la responsable de los cambios globales tan peculiares?
Sigo pensando en esto. Me mantengo al tanto.
Aldo González-Serva
Dermatopatólogo
Boston, USA
———————————————————————-
1: Int J Dermatol. 2002 Jun;41(6):335-9.
Bullous lesions in scleroderma.
Rencic A, Goyal S, Mofid M, Wigley F, Nousari HC.
Department of Dermatology, of Johns Hopkins University, School of Medicine,
Baltimore, MD, USA.
BACKGROUND: The occurrence of bullous lesions in localized or systemic scleroderma is rare. Three histologic patterns have been reported: lichen sclerosus et atrophicus-like, lymphangiectatic blisters and autoimmune blistering diseases. OBJECTIVE: To investigate the frequency, clinical, and immunopathologic features of patients with scleroderma and bullous eruptions and to review the literature regarding this rare condition. METHODS: A retrospective study of 53 cases of scleroderma (localized, generalized, and systemic) in the dermatology and rheumatology clinics at one institution over an 8-year span. Clinical, serologic, and immunopathologic findings were analyzed in four cases. RESULTS: Four of 53 patients exhibited bullous lesions in association with scleroderma. The first case illustrates lymphangioma-like clinical and pathologic presentation. The second case demonstrates bullous lichen sclerosus et atrophicus-like pattern. The other two cases exemplify a superimposed autoimmune skin disease, epidermolysis bullosa acquisita and penicillamine induced pemphigus foliaceus after treatment for systemic scleroderma. CONCLUSIONS: Of the 53 original patients, we have described four cases of bullous scleroderma (7.5%) Illustrating several pathogenetic mechanisms of bulla formation. inflammatory (lichen sclerosus et atrophicus), fibrotic/obstructive (lymphangiomatous), autoimmune (epidermolysis bullosa acquisita), and pemphigus foliaceus. The final case illustrates bullae as a complication of therapy for the underlying scleroderma.
PMID: 12100687 [PubMed – indexed for MEDLINE]
2: Am J Dermatopathol. 1997 Aug;19(4):379-83.
Bullous lesions in Kaposi’s sarcoma: case report.
Borroni G, Brazzelli V, Vignoli GP, Gaviglio MR.
Department of Human and Hereditary Pathology, University of Pavia, IRCCS,
Policlinico S. Matteo, Italy.
Bullous lesions have been only rarely described in Kaposi’s sarcoma (KS), and their histopathologic features have never been described in detail. We report a
case of bullous lesions of KS in an 82-year-old Italian woman. The patient had typical smooth pale reddish-grey slightly-raised KS plaques on the legs, present for at least 10 years. Several dull grayish-pink blisters (0.5 to 2 cm in diameter) affected both dorsa of her feet and ankles symmetrically. Two punch biopsies were taken, one from an infiltrated KS plaque on the right buttock and the other from a bullous lesion on the right foot. Histopathologically, the late KS plaque on the buttock showed typical features of KS, with an increased number of spindle cells arranged in short bundles and extravasation of erythrocytes. The bullous lesion on the foot showed a full-thickness vascular neoplasm involving the upper and lower dermis and the subcutaneous fat. The upper portion of the lesion contained many newly formed, highly-dilated blood vessels, touching the overlying epidermis and separated from it by a narrow band of collagen and endothelial cells; wide, empty spaces characterized the superficial dermis, in which preexisting venules and bands of collagen associated with non-atypical endothelial cells floated. All these findings would suggest a lymphangiomatous lesion, if the presence of specific diagnostic criteria of KS were not recognizable at a deeper level of the lesion. Various criteria actually suggest that the bullous lesion may be regarded as an epiphenomenon of a KS plaque lesion: (a) full-thickness involvement of the reticular dermis and, in this case, also of the subcutaneous fat; (b) dense and patchy lymphoplasmocytic infiltrate typical of plaque lesions and, much less frequently, of patch lesions; (c) presence of ectatic blood vessels, filled with plasma and erythrocytes (pseudoangiomatous findings), a nonpathognomonic but highly characteristic finding of the plaque lesion; and (d) as in the KS plaque lesions, in the bullous lesion as well the reticular dermis was characterized by an increased number of anastomosing bizarrely shaped vascular spaces lined by non-atypical endothelial cells. We hypothesize that the prevalence of lymphangiomatous differentiation in the upper dermis represents one of the many features of KS lesions. When present, it may correlate with the clinical feature of a blister.
PMID: 9261473 [PubMed – indexed for MEDLINE]
3: Clin Exp Dermatol. 1991 Mar;16(2):124-6.
Chylous reflux into abdominal skin simulating lymphangioma circumscriptum in a patient with primary intestinal lymphangiectasia.
O’Driscoll JB, Chalmers RJ, Warnes TW.
Department of Dermatology, Manchester Skin Hospital, UK.
A 47-year-old man with primary intestinal lymphangiectasia developed chylous reflux into the skin of the right flank. The clinical appearance resembled lymphangioma circumscriptum with multiple dome-shaped vesicles filled with milky-white fluid which discharged on to surrounding skin. Backflow of chyle into the skin of the lower limb, perineum or external genitalia has been described as a rare finding in patients with primary lymphoedema but we believe this to be the first case involving the abdomen and the first case describing chylous reflux into the skin in a patient with intestinal lymphangiectasia.
PMID: 2032374 [PubMed – indexed for MEDLINE]
———————————————————————-
si… lo primero que se me vino a la testa fué el quiste mixoide, que Aldo y su barra, tienen que recoger después de Ackerman… lo conecen muchisísimo mejor que un aficionado… linda la otra posibilidad… es la evolución y tengámonos en las de atrás… afirmaremos y disentiremos… nos lo enseñó ese maestro… que dices Rolando?
Un saludo,
Jairo Mesa Cock.
Manizales, Colombia
Es realmente difícil inclinarse hacia una u otra opción. El nódulo de aprox. 5 mm. de diámetro, bastante translúcido luce como una lesión linfangiomatosa, pero por la textura del líquido ( espeso viscoso amarillento mencionado) y recidivante, pudiera ser igualmente un ganglioma, además está anclado a nivel de la articulación interfalangica. La histología está modificada por las recidivas y tratamientos recibidos. Los factores de reepitelización que ocurren en ampollas de vieja data, dificultan arrivar a un Dx. preciso.
Creo, al igual que Jairo, que la evolución, determinará la naturaleza exacta de esta patología.
Un saludo cordial,
Dr. Guillermo Planas Girón
Caracas-Venezuela
Nos llama la atención de las dos hileras de células que tapizan algunas estructuras tubulares o pseudoquisticas, no les sugiere un TUMOR DE ANEXO?
Estimados colegas:
Las hileras de células en los espacios subepidérmicos y epidérmicos, que son reales y no artefactos en lo que ahora parece una madriguera, están constituidas por queratinocitos modificados por la presión de la mucina (o linfa).
Estoy de acuerdo que esos queratinocitos son cuboidales o endotelioides, más cercanos en interpretación a que sean queratinocitos apoptóticos como los autores proponen.
Algo parecido pasa en los nevus intradérmicos con linforragia o con mucina. Los nevocitos alrededor del fluído se «endotelializan» por la presión hidrostática que reciben y de allí que se hable de nevos «angiomatoides». En realidad y en otras palabras, no hay células endoteliales verdaderas ni espacios vasculares reales en estos nevos, sino un revestimiento nevoide reactivo a la presión que el fluído ejerce sobre estas cisternas que los contiene.
En breve, no favorezco un tumor anexial sino una peculiar reacción pseudoangiomatosa tubular que yo no había visto hasta ahora y que merece ser reportada en una Carta al Editor de alguna revista dermatológica o dermatopatológica.
Saludos,
Aldo González-Serva
Dermatopatólogo
Boston, USA
Gracias a todos por las interesantes respuestas, hemos (autores) aprendido mucho con este caso.
Tomarè las recomendaciones de Aldo.
Rolando Hernandez Perez
Roma/19/12/2008
Estimados colegas:
He revisado las láminas, así como otras que yo realicé en mi laboratorio, y concluyo que la lesion es puramente un quiste mixoide digital.
El aspecto pseudoglandular o pseudovascular de la epidermis que está degenerando bajo el embate de la presión de moco extravasado es una reacción peculiar y única, pero que es parte del espectro de la necrosis y ruptura epidérmica que ocurriría en poco tiempo antes de la mucorragia que acompaña al llenado cíclico de este pseudoquiste.
Como todavía creo que la uña de ese dedo muestra aspecto amarillento que pudiese ser derrame de moco a distancia, yo recomendaría estudiar histologicamente el borde de la lámina ungueal (mediante ‘clipping’ indoloro) y practicar coloración de Azul Alciano a ver si esta hipótesis es correcta.
Saludos,
Aldo González-Serva
Dermatopatólogo
Boston, USA