En esta edición el Dr. Alexis Mendoza-León invita al Dr. José E. Cardier a escribir en Ventana Molecular. JC es Investigador Titular en el Laboratorio de Patología Celular y Molecular, y Jefe de la Unidad de Terapia Celular del Centro de Medicina Experimental del IVIC. Una de sus líneas de investigación está relacionada con el uso de células madre en modelos experimentales de enfermedades y el potencial desarrollo de posibles aplicaciones terapéuticas en pacientes
Células Madre: biología y potenciales usos en medicina regenerativa.
José E. Cardier, MD.
Las células madres (CM) constituyen los elementos fundamentales a partir de los cuales pueden diferenciarse diversos tipos de células del organismo (1). Procesos de formación de vasos sanguíneos (vasculogénesis/angiogenésis), músculo (miogénesis), sistema nervioso (neurogénesis) y aun diferenciación a células de hígado han sido reportados a partir de CM provenientes de diferentes orígenes (1). Basados en estas evidencias se ha planteado el posible uso de las CM en terapias regenerativas de órganos y tejidos. De acuerdo a la localización de las CM, durante el desarrollo del individuo, estas pueden clasificarse en CM embrionarias (CME), CM adultas y las reprogramadas o pluripotentes inducidas. Pudiendo quizás agregarse otra categoría representada por tejidos fetales (por ejemplo, CM de liquido amniótico, de sangre de cordón umbilical, de anexos fetales etc. Las CM localizadas en MO están asociadas fundamentalmente con el sistema hematopoyético (generación de células sanguíneas), y se les denomina CM hematopoyéticas (CMH). La facilidad de obtención de las CMH, en la etapa postnatal y adulta del individuo, ha permitido estudiar ampliamente la capacidad de autorenovación, diferenciación y proliferación de estas células. Muchos de los conocimientos generados sobre la biología de las CMH han sido extrapolados a CM localizadas en otros tejidos.
Uno de los campos de mayor investigación en el área de las CM, lo constituyen las células madre embrionarias (CME), las cuales son obtenidas de la masa celular interna (MCI; “inner cell mass”) en la etapa de blástula. Una de las características más importantes de las CME es su capacidad de autorenovación ilimitada (dan origen a “copias” de ellas mismas, manteniendo el estado indiferenciado) y pluripotencialidad (dan origen a todos los tipos de células del organismo) (2). Basado en esta capacidad, se ha planteado la posibilidad de que las vías de diferenciación y desarrollo de las CME puedan ser controladas y/o reguladas ex vivo para el desarrollo de CM específicas de tejidos y órganos. La capacidad de autorenovación y diferenciación de las CME está directamente relacionada con la expresión de determinados genes durante cada estadio de diferenciación de las CM (3). Así, se conoce que los genes Sox-2, Oct-4, Klf-4 y c-myc juegan un papel fundamental en el mantenimiento de la pluripotencialidad de las CM. Basado en este conocimiento, recientemente se reportó que células somáticas adquieren la capacidad pluripotencial de las CME (CM pluripotentes inducidas, CMPi, o “inducible pluripotent stem cells, iPS”), posterior a la transfección de estos genes (3). Las CMPi no solo pueden autorenovarse, sino también pueden dar origen a cualquier tipo de células. En nuestro laboratorio hemos desarrollado técnicas de cultivo y diferenciación de CME (provenientes de ratón) (4).
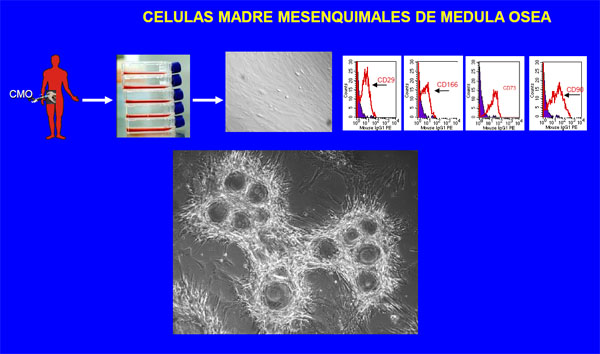
Las células madre adultas son específicas del tejido, esto significa que se las encuentra en un tejido determinado del cuerpo donde generan células maduras. El desarrollo continuo de técnicas de cultivos celulares de CM ha permitido el poder cultivar y expandir estas células in vitro, y evaluar su potencial uso clínico. En nuestro laboratorio hemos desarrollado técnicas de cultivo no solo para expandir sino para diferenciar algunos tipos de CM provenientes de diferentes tejidos. Así, el aislamiento y cultivo de CM hematopoyéticas (CMH) de médula ósea nos ha permitido obtener diferentes células sanguíneas a partir de CMH (5). Actualmente existe un gran interés en el uso clínico de CM mesenquimales (CMM), las cuales in vitro son capaces de autorenovarse y proliferar por largos períodos de tiempo, manteniendo su capacidad de diferenciación hacia células que conforman tejidos mesodérmicos, tales como osteoblastos, fibroblastos, condroblastos, adipocitos, mioblastos esqueléticos, entre otros. Con relación a la obtención de CMM, en nuestro laboratorio hemos obtenido estas células no solo de médula ósea, sino también de pulpa dental humana, líquido amniótico, mucosa olfatoria y cerebro. El desarrollo de tecnologías de aislamiento y cultivo de CMM nos ha permitido iniciar protocolos clínicos de trasplante autólogo de CMM para regeneración de hueso en pacientes con seudoartrosis (adquiridas o de tipo congénito).
A pesar de que en muchas instituciones médicas, con frecuencia sin fundamentación ni permisología adecuadas y con intenciones oscuras, se administran tratamientos basados en CM, actualmente el transplante de médula ósea constituye la única terapia, basada en CM, que ha demostrado su efectividad clínica en humanos. Con relación a otras posibles aplicaciones de CM en clínica (regeneración cardíaca, diabetes tipo1, enfermedades degenerativas del sistema nervioso), muy pocos son los reportes que se pueden encontrar en revistas médicas de impacto internacional, sobre la efectividad clínica del uso de CM en humanos. Algunas enfermedades o lesiones óseas, de la piel y córnea pueden ser tratados con injertos de tejido que depende de células madre de esos órganos y son generalmente aceptadas como seguras y efectivas por la comunidad médica (6). Basados en reportes que demuestran la regeneración de cornea a partir de CM aisladas de la región limbal, en nuestro laboratorio hemos iniciado estudios en animales para el aislamiento de estas células, para su posterior implante en modelos experimentales de regeneración corneal en conejos.
La sangre de cordón umbilical (SCU) es usada como una alternativa a la medula ósea, como fuente de CMH, para transplante alogénico. El éxito del uso de CM de SCU se basa en que parecen ser más eficientes en cuanto a la repoblación medular, generar menos rechazo y menos incidencia de enfermedad de injerto contra huésped. Esto último, ha traído como consecuencia una proliferación de compañías que ofrecen el servicio de colección y mantenimiento de sangre de cordón umbilical para fines de uso privado, con la consecuente comercialización de estos servicios usando argumentos no sustentados científicamente, y especialmente con la promesa de tratamientos potenciales, pero no probados clínicamente (ofrecimientos de “un seguro de vida para su hijo y su familia”) (7). En todo caso, y sin lugar a dudas, el almacenamiento de sangre de cordón umbilical para ser usada por quien necesite el transplante de CMH, y sea compatible, debería funcionar en “Bancos de Sangre de Cordón Umbilical de Acceso Público”. Este tipo de Bancos funcionan en muchos países, asociados entre ellos en redes, y constituyen una necesidad actual en los servicios de salud de cualquier país.
El conjunto de conocimientos generados de las investigaciones sobre células madre y el potencial impacto de estas en medicina, llevó recientemente al comité del Premio Nobel de Medicina a reconocer a los Doctores John Gurdon y Shinya Yamanaka por sus descubrimientos en el área de células madre. Ambos autores demostraron, Gurdon en 1962 y Yamanaka en 2006, que células maduras (celulas de la sangre o de la piel) pueden ser “reprogramadas” y transformarlas en células madre primitivas de tipo embrionario, y a partir de estas dar origen a cualquier tipo de célula del organismo. Este conocimiento no solo rompió el dogma biológico de que una vez que una célula se había especializado (ej., linfocito o fibroblasto) no se podía cambiar su estado y menos transformarse en una célula madre; sino también revolucionó el campo de la biología de la diferenciación celular. John Gurdon demostró en ranas que el reemplazo del núcleo de un óvulo por el de una célula intestinal, no solo daba origen a un óvulo modificado sino que este podía desarrollarse en un embrión normal. El Dr Yamanaka, basado en estos conocimientos y en aquellos que demostraban que el estado primitivo/indiferenciado de una célula madre embrionaria (CME pluripotente) dependía de que ciertos genes (Oct3/4, Sox2, c-Myc, Klf4) estuvieran ¨prendidos o activados¨ (expresados), logró colocar (transfectar) estos genes en fibroblastos, logrando que estas células se transformaran en células madre pluripotenciales de tipo embrionario (iPS), a partir de las cuales se puede generar todos los tipos celulares del organismo (ver figura anexa). Este proceso se conoce con el nombre de reprogramación celular. “Los descubrimientos de Gurdon y Yamanaka han demostrado que las células especializadas pueden bajo ciertas circunstancias echar marcha atrás en el reloj del desarrollo (Comité Nobel 2012)”. El Premio Nobel de Fisiología y Medicina a los Dres. Gurdon y Yamanaka, junto al recibido por el Dr. Thomas (1990) por sus trabajos en trasplante de médula ósea, no solo reconocen el impacto y trascendencia de los descubrimientos en la biología de células madre, sino también permiten informar a la comunidad mundial sobre la seriedad con la que debe llevarse a cabo la investigación científica en esta área.
La generación de iPS ha permitido obtener, en los laboratorios, células madre similares a las embrionarias para posibles usos terapéuticos, sin necesidad de recurrir al uso de embriones. Actualmente se han generado iPS a partir de cualquier tipo de células madura (fibroblastos, linfocitos, etc) de pacientes con determinadas enfermedades (anemia de Fanconi, diabetes tipo 1), lo cual ha permitido estudiar: los mecanismos involucrados en la patogenia de estas enfermedades, el efecto de drogas en las células de estos pacientes y la posibilidad de generar células maduras para su uso en medicina regenerativa. Además, como las IPSC provienen de las propias células de un paciente, los posibles tratamientos con estas células evitarían cualquier rechazo del sistema inmune. Sin embargo, es importante mencionar que la capacidad de formar tumores por las iPS no hace viable, en la actualidad, el uso de estas células en pacientes.
Referencias
- Klimanskaya I, et al. Derive and conquer: Sourcing and differentiating stem cells for therapeutic applications. Nature Rev Drug Discov. 2008; 7:131-142 http://www.nature.com/nrd/journal/v7/n2/full/nrd2403.html
- Thomson JA,et al. et al. Embryonic stem cells lines derived from human blastocysts. Science. 1998, 282:1145-1147. http://www.sciencemag.org/content/282/5391/1145.full.pdf
- Takahashi K, Yamanaka S. Induction of pluripotent stem cells from Mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006; 126:663–676. http://www.cell.com/abstract/S0092-8674(06)00976-7
- Silva I, Cardier JE. Liver sinusoidal endothelial cells support the survival and undifferentiated growth of the CGR8 mouse embryonic stem cell line: Possible role of leukemia inhibitory factor (LIF). Cytokine. 2011; 56: 608-615. http://www.sciencedirect.com/science/article/pii/S1043466611007150
- Diaz-Solano D, et al. Human olfactory mucosa multipotent mesenchymal stromal cells promote survival, proliferation and differentiation of human hematopoietic cells. Stem Cells and Development 2012 (en prensa)
- International Society for Stem Cell Research. www.isscr.org
- Sullivan M. Banking on cord blood cells. Nature Review Cancer. 2008; 8: 554-563 http://www.nature.com/nrc/journal/v8/n7/pdf/nrc2418.pdf
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998


Excelente esta ventana molecular, que demuestra la calidad de investigadores y ciencia que se hace en el país, pese a todas las dificultades.
Muchas gracias por la información!!…