Herramienta para una mejor prevención y esquemas terapéuticos novedosos….
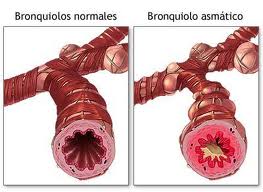
El asma bronquial es una enfermedad respiratoria crónica hereditaria y de alta prevalencia mundial. Se expresa con episodios de bronco espasmo, aumento en volumen y viscosidad del moco bronquial que ocasionan síntomas como disnea y dificultad respiratoria. La mayoría de las veces asociada a otras patologías alérgicas mediadas por la inmunoglobulina E (IgE).
 Los genes asociados al asma bronquial son numerosos y tienen múltiples funciones, pueden ser receptores o mediadores de la respuesta inmune o componentes de tejido bronquial o vascular. Entre ellos se han identificado mediante estudios de ligamento genético y mapeo fino ADAM 33, NPSR?, PHFII, HLA-G.
Los genes asociados al asma bronquial son numerosos y tienen múltiples funciones, pueden ser receptores o mediadores de la respuesta inmune o componentes de tejido bronquial o vascular. Entre ellos se han identificado mediante estudios de ligamento genético y mapeo fino ADAM 33, NPSR?, PHFII, HLA-G.
Se ha propuesto que en la patogénesis del asma participan además de varios genes con efectos variables, factores ambientales y se ha sugerido que los mecanismos epigenéticos pueden mediar parte del efecto de estos factores ambientales en la enfermedad.
La epigenética se refiere a los cambios en la expresión genética heredables que no son codificados en la secuencia de ADN.
La diversidad genética existente en los organismos vivos determina la expresión y caracterización del fenotipo correspondiente a cada individuo. La exposición ambiental puede inducir cambios moleculares que se heredan y se expresan produciéndose así los cambios epigenéticos.
Los mecanismos moleculares que determinan estos cambios son la metilación o desmetilación del ADN, la acetilación, desacetilación y fosforilación de histonas, modificaciones en los micros ARN y alteraciones cromatínicas.
La regulación epigenética provee un mecanismo atractivo para explicar diversas asociaciones entre exposiciones prenatales y el desarrollo posterior de patologías en niños y adultos. La exposición intrauterina al cigarrillo, infecciones bacterianas y virales, la dieta materna y la polución ambiental son factores que desencadenan procesos epigenéticos, así como la acetilación de histonas, la inducción de citoquinas inflamatorias, la polarización de la respuesta inmune hacia el tipo TH2 y una mayor producción de IgE, cambios que inducen la aparición de los síntomas de asma bronquial. La heterogeneidad del fenotipo atópico se debe a exposiciones ambientales individuales de estos pacientes. El asma y otras patologías alérgicas se desarrollan con más facilidad en niños nacidos de madres atópicas al compararlos con niños con padres alérgicos, sugiriendo una programación intrauterina de estos cambios. Más aún se han encontrado genes atópicos susceptibles a regulación epigenética, entre ellos las vías de células T efectoras (INF-?), IL4,IL 10, IL 17, vías regulatorias de células T ( Fox P3), y en la inflamación de las vías aéreas en el asma bronquial con la producción de oxido nítrico sintetasa (iNOS).
Transmisión de los cambios epigenéticos a otras generaciones.
 Se pensaba que la transmisión de estos cambios era imposible. Sin embargo, trabajos experimentales en ratones han demostrado lo contrario. Por ejemplo, el efecto protector de microorganismos para el desarrollo del asma que se ha propuesto en niños que nacen en el medio rural (hipótesis de la higiene) se ha demostrado en experimentos con ratones. Investigadores estudiaron el efecto protector en ratones de una bacteria Gram negativa, Acinetobacter lwoffii, procedente de granjas. Ratones BALB/c sensibilizados a la ovalbúmina, se compararon con ratones no sensibilizados y todos fueron expuestos a este microorganismo durante el embarazo. Se demostró que las células T esplénicas de la descendencia de ratones estimulados tenían menos habilidad de producir citoquinas Th2 y la producción de INF-? permanecía intacta, sugiriendo un control hacia la alergia de estos ratones. Cuando posteriormente a un grupo de estos roedores se les suprimía la producción de INF-?, comenzaba de nuevo a aparecer el perfil Th2. Esto sugiere que la exposición pre natal a esta bacteria estimulaba el perfil Th1, protegiendo así contra enfermedades alérgicas. Han sido publicados diversos trabajos experimentales que demuestran el paso de la metilación epigenética de padres a hijos en estudios experimentales. Queda por demostrarse este fenómeno en humanos.
Se pensaba que la transmisión de estos cambios era imposible. Sin embargo, trabajos experimentales en ratones han demostrado lo contrario. Por ejemplo, el efecto protector de microorganismos para el desarrollo del asma que se ha propuesto en niños que nacen en el medio rural (hipótesis de la higiene) se ha demostrado en experimentos con ratones. Investigadores estudiaron el efecto protector en ratones de una bacteria Gram negativa, Acinetobacter lwoffii, procedente de granjas. Ratones BALB/c sensibilizados a la ovalbúmina, se compararon con ratones no sensibilizados y todos fueron expuestos a este microorganismo durante el embarazo. Se demostró que las células T esplénicas de la descendencia de ratones estimulados tenían menos habilidad de producir citoquinas Th2 y la producción de INF-? permanecía intacta, sugiriendo un control hacia la alergia de estos ratones. Cuando posteriormente a un grupo de estos roedores se les suprimía la producción de INF-?, comenzaba de nuevo a aparecer el perfil Th2. Esto sugiere que la exposición pre natal a esta bacteria estimulaba el perfil Th1, protegiendo así contra enfermedades alérgicas. Han sido publicados diversos trabajos experimentales que demuestran el paso de la metilación epigenética de padres a hijos en estudios experimentales. Queda por demostrarse este fenómeno en humanos.
Collison y colaboradores (2011) aplicaron un modelo murino con sensiblidad alérgica bronquial inducida por polvo de casa, para estudiar cambios en miRNA. Demostraron niveles elevados de miRNAs en las vías aéreas de estos ratones estimulados con polvo de casa y cuando se inhibía específicamente se suprimía la inflamación alérgica. También el tratamiento con dexametasona reducía la producción de citoquinas Th2 de manera que la acción de este corticosteroide es potente.
Epigenética Farmacológica.
Conocemos que desde hace décadas se utilizan los corticosteroides para el tratamiento del asma bronquial. Pero es ahora, con los conocimientos de genética y epigenética, cuando podemos conocer que su acción anti-inflamatoria sobre los genes de la inflamación se realiza mediante la acetilación de las histonas. Este y otros mecanismos de acción de esteroides y prostaglandinas han sido estudiados, demostrando la reversibilidad de estos cambios genéticos.
Estudios en la epigenética de patologías alérgicas y específicamente en asma bronquial tienen el reto de identificar nuevos blancos para dirigir hacia allí esquemas terapéuticos que nos permitan disminuir los síntomas de estas patologías alérgicas. Se han conseguido evidencias de la transmisión de estos cambios epigenéticos a la descendencia y la existencia de la farmacología epigenética.
Estudios de este tipo han permitido conocer más detalladamente el mecanismo de producción del asma y otras patologías alérgicas permitiendo un mejor conocimiento de aspectos de la producción de la inflamación alérgica lo que podría incidir en el descubrimiento de nuevas herramientas terapéuticas.
Bibliografía:
- Alati R y col (2oo6)
- Lim RH y col (2010)
- Miller RL y col (2008)
- Kuriakose JS y Miller RL (2010)
- Martino D y col (2010)
- Su R y col (2010)
- Collison A y col (2011)
- Douwes J y cool (2008)
- Schmitz RJ y col (2011)
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
