Los desordenes neurodegenerativos producidos por los agentes proteicos infecciosos conocidos como priones, son producidos por la deposición en células del sistema nervioso central, tanto en animales como humanos, de agregados de proteína priónica celular (PrPC) que ha sufrido cambios de su plegamiento normal de alfa hélice a un plegamiento tipo lámina beta (PRPSc). Estos agentes infecciosos son transmisibles y pueden “replicarse” en ausencia de ácidos nucleicos, ya que el fraccionamiento de los agregados formados generan nuevas partículas infecciosas.1 En animales, el mejor ejemplo de estos desórdenes es el síndrome de las vacas locas, mientras que en humanos tenemos la enfermedad de Creutzfeld-Jakob (CSJ) y el kuru. Otros desórdenes degenerativos en humanos como Alzheimer y la enfermedad de Parkinson, han sido asociadas a alteraciones de plegamiento de proteínas y acumulación de agregados amiloideos; sin embargo, no se consideran asociadas a priones ya que no se ha demostrado su transmisibilidad entre individuos. 2 No existen, a la fecha, tratamientos o terapias efectivas para estos desórdenes.
El proceso de “replicación” de los priones a través de la disgregación de los agregados que forman, es clave en el mantenimiento del proceso neurodegenerativo. Una pregunta importante al respecto, sería la siguiente: ¿es posible bloquear tal proceso, por ejemplo mediante la estabilización de los agregados?; esto impediría la formación de nuevos priones y por ende la conversión de PrPC a PrPSc, es decir, tendríamos una actividad antiprión.
Estudios previos sobre la inhibición de la propagación de agregados amiloideos, permitieron la identificación de conjugados luminiscentes de politiofeno (LCP, siglas en inglés) que tienen una gran especificidad para enlazarse a distintos agregados amiloideos y características espectrales propias para cada amiloide; tales compuestos tienen baja toxicidad.
El análisis de los espectros de fluorescencia, en estudios in vitro utilizando diversos LCPs y diversos tejidos infectados por priones, muestra que estos compuestos se enlazan preferentemente a agregados de proteína que presentan estructuras repetidas de láminas beta, incluidos aquellos amiloides formados por PrPSc. La especificidad y sensibilidad de la detección de estos agregados unidos a LCPs, es similar a la que se produce con el colorante rojo Congo, utilizado en la distinción de distintas cepas de priones.3,4 De igual forma, estos experimentos demostraron que el tratamiento de LCPs en cortes de cerebro de ratón previamente infectados, generan la reducción de la infectividad de los priones, sugiriendo la estabilidad de los agregados.3
Experimentos in vivo, utilizando un modelo de ratón infectado con un prión, determinaron el valor terapéutico de los LPCs, ya que prolongaron la sobrevivencia de estos ratones.5
¿Cuál es el tipo de interacción que determina la actividad antiprión de estos LPCs?. El análisis estructural de estos compuestos mediante técnicas de resonancia magnética nuclear (NMR) y simulación de enlazamiento al prion HET-s, un prión de hongos cuya estructura atómica es conocida, demostró una interacción electrostática que involucra directamente las láminas beta de los agregados del prión, sugiriendo una estabilización de los agregados.
Los resultados anteriores y el uso de métodos de dinámica molecular, permitieron el diseño de nuevos politiofenos con mayor efectividad terapéutica. Uno de ellos prolongó la sobrevivencia de ratones infectados con priones, y el análisis histológico de tejido cerebral de estos animales mostró un retardo en el proceso neurodegenerativo, con estabilización de los agregados amiloideos y reducción de los mismos en comparación con animales no tratados. Estos resultados demuestran por primera vez la posibilidad de prevenir la muerte de tejido cerebral en una enfermedad neurodegenerativa, y validan el uso de LCPs como agentes antipriónicos. 5
Algunas limitaciones en el uso de estos compuestos han sido señaladas. En primer lugar, la selectividad de distintas cepas de priones; lo cual hace necesario evaluar la acción de estos compuestos en múltiples cepas. Segundo, la no existencia de otros modelos estructurales de priones distintos de HET-s, limita la predicción de la actividad biológica de los LCPs ya que otros priones son moléculas distintas. Tercero, dado que la estabilidad de los agregados amiloideos involucra el enlazamiento de LCPs a las láminas beta, una generalización al respecto debe ser establecida experimentalmente.
El estudio es de suma importancia clínica, generando una visión de futuro en el tratamiento de otras proteinopatias, como por ej. enfermedades humanas neurodegenerativas como el Alzheimer y la enfermedad de Parkinson que presentan alteraciones de plegamiento de proteínas y acumulación de agregados amiloideos. De gran interés sería la evaluación del enlazamiento de LCPs a los amiloides A beta y proteína tau asociadas a la enfermedad de Alzheimer, así como a la a-sinucleina presente en la enfermedad de Parkinson.
Finalmente, es de importancia llamar la atención en cuanto al trabajo multidisciplinario para llegar a establecer el diseño e identificación de nuevas drogas, el uso de métodos de modelaje y dinámica molecular en la simulación e identificación de blancos y regiones involucradas en la acción de drogas, en otras palabras Ciencia Translacional. El curso de tal investigación en su aplicación y evaluación clínica y el conocimiento mismo de estas enfermedades, nos llevará a lo que ahora conocemos como Medicina Traslacional.
Referencias
Mendoza-León A. 2014. http://goo.gl/8RO1Su
Goeder M. 2015. http://goo.gl/2QeH0C
Margalith et al., 2012. http://goo.gl/Hswl67
Sigurdson et al., 2007. http://goo.gl/LNqyv5
Herrmann et al. 2015. http://goo.gl/bwXhb4
Alexis Mendoza-León, PhD. Email: [email protected]
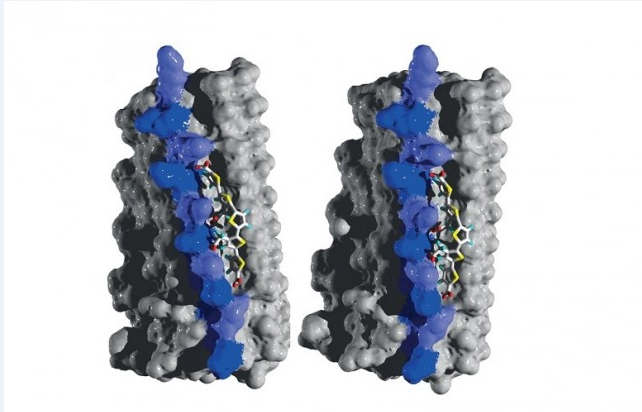
Imagen es un modelo de enlazamiento del LCP (LIN5001) al agregado generado por el prión HETs. La estabilización del agregado amiloideo previene la “replicación” del prión. Tomada de Herrmann et al. 2015.
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998

Excelente articulo sobre estas proteínas especiales que se han asociados a procesos neurodegenerativos graves, los estudios conducentes a evitar su replicación tal como lo explica, son importantes en enfermedades aun «inciertas» como el Alzheimer, Parkinson y otras en que impliquen el sistema nervioso, se esperan sorpresas.
Le felicito por darnos a conocer el concepto de Medicina Translacional, recoge en esta definición una buena parte de los estudios de nuevas drogas para tratar diversas patologías en humanos infecciosas o metabolicas, que dada su interdisciplinariedad la información puede encontrarse dispersa.
Alexis como siempre excelente escrito. Preguntas ¿ Porque hablas de infeccion, cuando son proteínas que aun no estan establecidas como seres vivos? Que tanto la asociacion de estos priones con el alzheirmer? En el pasado habia como una especie de boom en relacionarlo, hoy en dia ya no es tanto. Cual es el estatus?
Estimada luz Bettina gracias por su comentario. La integración de distintas áreas del conocimiento es un hecho y en la práctica el beneficio será mayor, ejemplos de ello abarcan áreas como lo señala en el desarrollo de nuevas drogas, nanomedicina, bioinformática, etc. La Ciencia y Medicina Traslacional son un hecho.
Estimado Jaime, excelentes comentarios, los cuales aprovecharé para hacer hincapie en algunos detalles de interés en el tema.
¿Por qué hablas de infección, cuando son proteínas que aun no están establecidas como seres vivos?
En 1982 el término PRION fue introducido por S. Prusiner, para distinguir proteínas patogénicas de virus. El cuestionamiento de su definición como “agente infeccioso” es producto de que la transmisión de la información biológica, en este caso, ocurre a través de una proteína, sin la intervención de ácidos nucleícos. Esto último era lo esperado, de acuerdo al concepto de transmisión de información biológica por parte de un ser vivo, de allí lo novedoso. La proteína normal que se transforma en prión, tiene codificación en el DNA del organismo afectado (Ver referencia 1).
Definición de infección. Etimol. Del latín infectio. 1. Transmisión o desarrollo de gérmenes que infectan o contaminan. 2. Enfermedad o trastorno producido por gérmenes.
Entonces, ¿Por qué considerar a un prión como un agente infeccioso y hablar de infección?
1. Un agente infeccioso lleva una información biológica que es transmisible, genera una infección por ejemplo. La información de un prión es transmisible, los priones aislados de encefalopatías que genera la enfermedad de las vacas locas se han utilizado exitosamente para generar la enfermedad en animales sanos. Resultados similares se muestran en humanos en la enfermedad de kuru, la cual se genera por rituales de canibalismo (Ver ref. 1)
2. Un agente infeccioso se multiplica manteniendo la infección. A diferencia de organismos patógenos como virus y bacterias cuya multiplicación es producto de la replicación de su DNA o RNA, los priones también se multiplican, o “replican”, a través de la disgregación de los agregados amiloideos generando nuevas partículas infecciosas que repiten y mantienen el proceso
En conclusión son proteínas con una información biológica, que se multiplica y mantiene el proceso infectivo.
¿Qué tanto la asociación de estos priones con el alzheirmer? ¿Cuál es el estatus?
La consideración de que enfermedades como Alzheimer y Parkinson están relacionadas con priones sigue vigente. La aceptación definitiva de ello ha estado limitada porque no se ha demostrado la transmisibilidad de las mismas entre individuos. Yo lo llamaría capacidad infectiva (Ver ref 2). Este mes de septiembre, el tópico ha estado en primera plana en diversos medios noticiosos internacionales debido a una reciente publicación en la revista NATURE (Jaunmutane et al. 2015. Vol 325, doi: 10.1038/nature15369) que sugiere la transmisión de Alzheimer a través de procedimientos de cirugía medica (transmisión iatrogénica). Los resultados provienen de un grupo de individuos muertos recientemente por la enfermedad de Creutzfeldt-Jacob (CJD: enfermedad producida por priones en humanos)), que durante su niñez (1958-1985) fueron tratados con hormona de crecimiento que había sido obtenida de extractos de pituitaria preparados de cadáveres, algunos de los cuales tenían Alzheimer. El trabajo mencionado demuestra que el extracto estaba contaminado con priones, y las personas recién muertas desarrollaron CJD; en algunos casos se encontró CJD asociado a Alzheimer, lo cual puede sugerir la transmisibilidad de esta última enfermedad. Sin embargo, los resultados no han sido considerados determinantes para concluir la transmisibilidad del Alzheimer.
El status de la enfermedad de Alzheimer asociada a priones sigue vigente; la necesidad de más ciencia traslacional, estaría implícita.
En un tema tan interesante y vigente, estos comentarios son importantes, gracias Jaime por ellos y espero haber respondido a ellos
Alexis tu comentario es una joya, te propongo que lo escrito aqui con una revision del articulo de Nature sobre la trasmision del alzheirmer me lo envies para publicarlo en una proxima edicion de Piel latinoamericana
Muchisimas gracias
Jaime Piquero Martin
Una excelente noticia, con sólidas evidencias para el control o cura del síndrome de las vacas locas, la enfermedad de Creutzfeld-Jakob (CSJ) o el kuru. Alexis Mendoza-León describe en forma comprensible y didáctica este complejo tópico. Recomiendo su lectura.