En esta edición el Dr. Alexis Mendoza-León invita al Dr. Felix A. Ruíz, a escribir en Ventana Molecular sobre su visión de la innovadora tecnología de edición de la información genética. El Dr. Ruíz inició su carrera de investigador obteniendo el título de Licenciado en Biología en la Universidad Central de Venezuela; obtuvo el título de Doctor en el Departamento de Biología Molecular de la Universidad Autónoma de Madrid. Investigador del Programa de incorporación de talento “Ramón y Cajal” (5 años) y Posdoctoral contratado en la Universidad de Illinois, USA (4½ años). Actualmente, es Profesor Titular en la Facultad de Medicina de la Universidad de Cádiz y Coordinador del Máster en Biomedicina (2009 a la fecha). Tiene participación en más de 30 artículos de investigación en revistas internacionales con 1200 citas; Cofundador de «Divulgades», iniciativa de divulgación que busca enfoques originales para que el ciudadano se enamore de las ciencias (http://www.divulgades.es/).
———-
“CRISPR”, el editor genético que promete cambiar la medicina
Felix A. Ruiz, PhD. [email protected]
 Elegido como “el hito científico del año” por la revista Science, por encima de la misión a Plutón, vacuna del Ébola o el acuerdo internacional contra el cambio climático. Te contamos qué es CRISPR y por qué ha levantado tanto revuelo en la comunidad científica. CRISPR son las siglas en inglés de ‘Clustered Regularly Interspaced Short Palindromic Repeats’ y – puede que incluso su traducción al Castellano – (‘Repeticiones palindrómicas cortas interespaciadas y agrupadas regularmente’), no nos diga mucho acerca de qué se trata.
Elegido como “el hito científico del año” por la revista Science, por encima de la misión a Plutón, vacuna del Ébola o el acuerdo internacional contra el cambio climático. Te contamos qué es CRISPR y por qué ha levantado tanto revuelo en la comunidad científica. CRISPR son las siglas en inglés de ‘Clustered Regularly Interspaced Short Palindromic Repeats’ y – puede que incluso su traducción al Castellano – (‘Repeticiones palindrómicas cortas interespaciadas y agrupadas regularmente’), no nos diga mucho acerca de qué se trata.
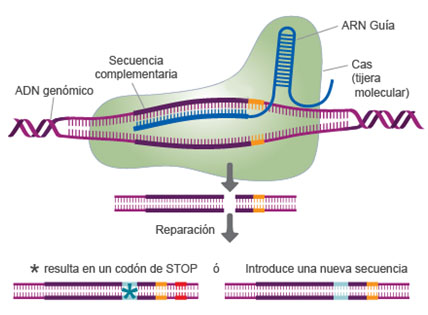
A pesar de tener unas siglas confusas y casi impronunciables, CRISPR (se suele decir “crísper”), no deja de acumular titulares de noticias y premios científicos. Es un sistema de edición del ADN, una técnica que nos permite cambiar específicamente una parte de la información genética de una célula o individuo. La técnica utiliza una enzima, una tijera molecular denominada ‘Cas’ (abreviatura de ‘CRISPR associated protein’). Esta tijera molecular usa un ‘ARN guía’, que la dirige justo hasta una secuencia diana en el ADN. En este sitio, la tijera molecular Cas realiza un corte que activa la maquinaria natural de reparación del ADN. Finalmente, como consecuencia de la reparación, se elimina un pequeño fragmento o se varía la secuencia del ADN (Figura 1).
La tecnología CRISPR/Cas surgió como una ‘domesticación’ de un sistema primitivo de inmunidad que existe en bacterias y que fue descrito a finales de los años 80. Las bacterias incorporan en su genoma pequeñas secciones de ADN de los virus que les infectan, para luego defenderse de posteriores infecciones. La defensa ocurre mediante la activación del ataque dirigido con las tijeras moleculares Cas, que cortan específicamente el ADN viral.
En el año 2012, las investigadoras Jennifer Doudna y Emmanuel Charpentier, fueron capaces de adaptar este mecanismo para modificar a voluntad cualquier genoma 1. Su descubrimiento ha obtenido destacados reconocimientos como el último premio Princesa de Asturias en Investigación Científica y el ‘Breakthrough Prize’ en Ciencias de la Vida (de 3 millones de dólares para cada una).
Anteriormente, ya existían otros métodos para editar el ADN, sin embargo CRISPR ha resultado ser el más específico, fácil y económico hasta el momento. Esto ha permitido realizar estudios que anteriormente eran imposibles o que podrían alargarse por años. Como por ejemplo, los trabajos de dos grupos de investigación que han utilizado CRISPR para estudiar el efecto de eliminar cada uno de los casi 20 mil genes que contienen varios tipos de células humanas. Con esto han identificado unos 1500-1800 genes que son esenciales para el crecimiento y la reproducción 2, 3.
Las inmensas posibilidades de CRISPR se han demostrado de sobra durante todo el año 2015 con una serie de sorprendentes estudios en diferentes sistemas. Entre otras cosas, CRISPR se ha propuesto como una nueva aproximación para combatir la trasmisión de la malaria. Los parásitos que ocasionan esta enfermedad se transmiten de un humano a otro a través de la picadura de mosquitos del género Anopheles. Utilizando CRISPR se ha logrado introducir, en el ADN de los mosquitos, genes que les otorgan resistencia a los parásitos de malaria 4. Estos genes introducidos producen anticuerpos de cadena simple: los denominados ‘m1C3’ y ‘m2A10’, dirigidos en contra de las proteínas CSP y quintinasa1 del parásito. Como los nuevos genes forman parte del ADN del genoma del mosquito, éstos pasan a las siguientes generaciones, manteniendo el efecto antiparasitario y ampliando la protección contra la infección.
La técnica CRISPR está generando también grandes expectativas en relación a terapias innovadoras contra enfermedades hereditarias raras. A finales del 2015, tres grupos de científicos usaron esta tecnología para tratar con éxito ratones con distrofia muscular de Duchenne 5. Esta enfermedad rara es causada por defectos del gen que codifica para la ‘distrofina’, una proteína que le otorga fuerza y protección a las fibras musculares. CRISPR se ha usado para eliminar los segmentos defectuosos en el gen de la distrofina en los ratones jóvenes con la enfermedad.
Así mismo, gracias a CRISPR se ha logrado eliminar más de 60 retrovirus integrados en el genoma del cerdo 6. Estos retrovirus habían sido hasta ahora uno de los impedimentos más importantes para el uso de ese animal como fuente de órganos para trasplantes.
Figura 1. Mecanismo de CRISPR/Cas. Adaptado ( http://www.transomic.com/)
Referencias.
- Jinek MA et al. (2012) Programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. http://goo.gl/27wuKH.
- Hart T et al. (2015) High-Resolution CRISPR Screens Reveal Fitness Genes and Genotype-Specific Cancer Liabilities. http://goo.gl/qGHLCm.
- Wang T (2015) Identification and characterization of essential genes in the human genome. http://goo.gl/vwfAsl.
- Gantz VM (2015) Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. http://goo.gl/bijmNm.
- Kaiser J (2015) CRISPR helps heal mice with muscular dystrophy. http://goo.gl/8yWFXO.
- Yang L (2015) Genome-wide inactivation of porcine endogenous retroviruses (PERVs). http://goo.gl/qkz51M.
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998


Muy oportuno para mí éste excelente artículo sobre CRISPR y les explico porqué. Hace un par de días me llego un artículo vía Intramed News titulado: “Mosquitos con genes editados para erradicar el Zika”. Como me agradó el contenido y no entendía totalmente el mecanismo, consulté otros artículos relacionados y llegué al original que plantea el trabajo. Logré acceder a parte del mismo, no completo; pero suficiente para mí.
Resulta que hay un sector de la comunidad científica que mira el Zika hacia el vector que la transmite, el mosquito Aedes aegypti. Las hembras son las hematófagas y los machos succionadores de néctar. Los expertos proponen controlar a las hembras responsables de las picaduras con la herramienta de edición del genoma CRISPR-Cas9. Estas tijeras moleculares permitirían reasignarles el sexo y convertirlos en inofensivos machos.
El artículo original, publicado en la revista Trends Parasitology plantea una estrategia efectiva y barata como es el manejo de los genes de la virilidad con el sistema CRISPR-Cas9 produciendo oleadas de mosquitos solo machos, lo cual permitiría la eliminación definitiva del vector y por tanto la propagación del agente causal de la enfermedad.
Adelman ZN, entomólogo en Virginia Tech (USA) y autor principal del trabajo consultado, confesó que necesitan más experimentos de laboratorio para saber cuánto tiempo se tardaría en tener una población inofensiva de mosquitos, pero es definitivamente posible. Son técnicas no exentas de riesgos y conflictos éticos pero hacia allá va la investigación en Zika. (Adelma ZN, Tu Z. Control of mosquito borne infectious diseases: sex and gene derive. Trends Parasitology 2016;32(3):219-29).
Me pareció muy interesante porque es ciencia real, posible y aplicable.
Ojalá sigan éstos artículos tan estupendos, enriqueciéndonos e ilustrándonos y sobre todo escritos por ilustres venezolanos tan destacados e inteligentes. Mis respetos,
Amalia Panzarelli
Dermatólogo
Caracas,Venezuela
Estimada Dra. Panzarelli,
Muchas gracias por su comentario. El control del vectores de enfermedades, mediante CRISPR, es uno de los campos que está teniendo gran atención. Estoy de acuerdo con Ud. que esta técnica podría determinar las vías en la investigación para erradicar el Zika.
Le agradezco mucho la sugerencia de la revisión en la revista ‘Trends in Parasitology’ (2016;32(3):219-29), es muy completa y muy reciente (a publicarse en el número de marzo 2016). Insiste en el uso de CRISPR para estimular la herencia sesgada de genes en mosquitos, y así, modificar las poblaciones enteras. Es lo que se denominado como ‘Gene drive’.
También aprovecho para agradecer la invitación del Dr. Mendoza-León a colaborar en Piel-L.
Saludos cordiales
Felix A. Ruiz
Y podremos algun dia en este «corta y pega» del ADN, tener la eterna juventud?
Entre en divulgades y me parecio muy intteresante, Gracias Profesor Ruiz por divulgar la ciencia a las nuevas generaciones http://www.divulgades.es/
Estimado Jaime,
Muchas gracias por tu comentario y por mencionar a nuestra iniciativa de divulgación.
¿Edición de ADN para la eterna juventud? creo que no será suficiente.
La edición de ADN podrá ayudarnos cada vez a paliar más daños y enfermedades. Y algunas de las mejoras serán para patologías comunes en edades avanzadas.
Sin embargo, el envejecimiento es un fenómeno muy complejo. Involucra genes pero también a muchos otros factores (por ejemplo cómo se expresan esos genes, proteínas, cambios ambientales, etc). Por eso, creo que para la \»eterna juventud\» se necesitarán otras técnicas, además de la edición del ADN.
Para los interesados, hay una revisión muy completa donde se exploran todas esas \»señas de identidad\» moleculares del envejecimiento: Cell. 2013; 153: 1194–1217 (http://www.ncbi.nlm.nih.gov/pubmed/23746838).
Saludos cordiales
Felix A. Ruiz