La piel es el mayor órgano humano ( ~ 1,8 m² en el adulto), cuya función más importante es establecer una barrera efectiva entre el interior y exterior de un organismo; tales barreras establecen propiedades de protección mecánica y de defensa contra patógenos y radiación ultravioleta (UV), entre otras. Estas funciones de barrera, son en gran medida llevadas a cabo por la epidermis, un epitelio escamoso estratificado, y por su capa más externa, la capa córnea. La inducción de la diferenciación de queratinocitos para formar un epitelio estratificado es esencial para la adquisición de la función de barrera epidérmica, al igual que la homeóstasis del tejido. La perturbación de estas propiedades de barrera suele estar asociada a enfermedades propias de la piel.1,2 El proceso de diferenciación de los queratinocitos está directamente relacionado con cambios secuenciales de la expresión genética asociados a diferentes mecanismos reguladores epigenéticos, que tienen efectos de activación o represión de genes o marcadores genéticos particulares. Esta red epigenética de regulación opera garantizando el mantenimiento y control de diferenciación de las múltiples estructuras que llevan a la formación de la piel. Estos cambios epigenéticos son heredables, sin alteración en la información genética contenida en la secuencia del DNA de un organism.3
El proceso de desarrollo epidérmico y diferenciación de queratinocitos está gobernado, en parte, por la expresión coordinada de una región de 2Mb (mega pares de bases en el DNA), llamada complejo de diferenciación epidérmico (EDC, de sus siglas en inglés), localizada en humanos en el locus 1q21 y en ratón en 3q, que contiene la información genética de proteínas estructurales y reguladoras que son de vital importancia para la diferenciación de los queratinocitos y las propiedades del estrato córneo para la formación de la piel.4
El análisis de secuencia de esta región muestra su conservación evolutiva entre diversos organismos y la sistenia (idéntica orientación de los genes que la conforman) de varias familias de genes asociados en esta región como: genes que codifican pequeñas proteínas ricas en prolina (small proline-rich región: SPRRs), proteínas tardías de la envoltura cornífera (late cornified envelope: LCE), proteínas que enlazan calcio (familia S100A) y las proteínas filagrina y parecidas a filagrina. Evidencias recientes sugieren un papel importante de la información genética presente en EDC, con la patogénesis de enfermedades inflamatorias de la piel como dermatitis atópica (AD) y psoriasis.4,5
La expresión y regulación coordinada de los genes que conforman el EDC durante el desarrollo embrionario de la piel y la diferenciación de la epidermis en adulto, sugiere una red molecular de elementos regulatorios comunes que coordinan y controlan dicha expresión. Igualmente, se han identificado en este locus secuencias no codificantes (conserved non-coding elements: CNEs), conservadas a través de la evolución, con actividad potenciadora especifica en la diferenciación de queratinocitos. El programa de desarrollo epidérmico y diferenciación de los queratinocitos se rige por la participación coordinada de varios factores de transcripción (p63, AP-1, Klf4, Arnt, etc.), vías de señalización (Wnt, Bmp, Hedgehog, EGF, Notch, FGF, etc. on), y reguladores epigenéticos modificadores de la cromatina dependientes de ATP [DNA / enzimas modifadoras de histona como metil-transferasas (DNMT) y deacetilasas (HDAC)] y RNAs no codificantes.1,2
Un elemento importante en estos eventos de regulación epigenética es el factor de transcripción p63, que cumple funciones claves en el proceso de formación de la piel; su ausencia en el desarrollo embrionario impide la estratificación epitelial. p63 está regulado transcripcionalmente por dos promotores, TA y dN, cuya expresión genera isoformas activas con funciones diferentes. Isoformas relacionadas con el promotor dN, N-p63, se expresa predominantemente en la capa basal y se requiere para mantener los queratinocitos en estado no diferenciado; mientras que isoformas del promotor TA, TA-p63, son necesarias para la iniciación de la estratificación de las capas epiteliales por parte de los queratinocitos, la cual es bloqueada por N-p63. A la fecha no ha sido posible determinar la importancia funcional de las isoformas de p63 en la estratificación de la epidermis, lo que limita la comprensión de la relevancia de cada isoforma con respecto a la determinación del linaje celular y la diferenciación.2
De igual manera, los factores de transcripción Fra-2 y AP1(proteína activadora 1) son importantes en la regulación de la diferenciación de queratinocitos, y su actividad está relacionada con la interacción de un mecanismo dual que involucra: a. inactivación de Fra-2 en queratinocitos no diferenciados por acetilación mediante una enzima que media la metilación de histonas (Ezh2), y b. activación de Fra-2 por fosforilación mediada por la enzima ERK1/2, promoviendo la activación de Fra-2/AP1 y la diferenciación de queratinocitos.2,6,7
Como vemos, los programas de expresión génica específicos que rigen la formación de la piel, involucran mecanismos de señalización/factor de transcripción dependientes y mecanismos epigenéticos, al igual que la expresión de pequeños RNA. Dada la complejidad en la interacción de los diversos eventos regulatorios epigenéticos, la búsqueda en la comprensión de cómo estos mecanismos reguladores funcionan en concertadamente para coordinar la expresión de genes específicos, es muy importante para la modulación eficaz de la actividad de células madre y su destino, al igual que el entendimiento de la regeneración de tejido y tratamiento de muchos desordenes de la piel. En la era de la ingeniería de tejidos, el desarrollo de nuevos enfoques en la regeneración de órganos, y la manipulación del epigenóma mediante su edición con el sistema CRISP/Cas, es de vital importancia el entendimiento de estos eventos epigenéticos de regulación en la formación de la piel. Un futuro prometedor nos espera en esta área de la ciencia y medicina traslacional.
Referencias
- Perdigoto CN et al. 2014. Epigenetic Regulation of Epidermal Differentiation. Cold Spring Harb Perspect Med 4:a015263; doi: 10.1101/cshperspect.a015263.
- Saldhana SN et al. 2016. Epigenetic Regulation of Epidermal Stem Cell Biomarkers and Their Role in Wound Healing. Int. J. Mol. Sci. 17, 16; doi:10.3390/ijms17010016.
- Mendoza-León. 2013. Epigenética: Diversidad celular sin alteración de la secuencia del DNA.
- Botchkarev VA. 2015. Epigenetic Regulation of Epidermal Development and Keratinocyte Differentiation. The Journal of Investigative Dermatology Symposium 17, 18–19; doi:10.1038/jidsymp.2015.15.
- Henry J et al. Update on the epidermal differentiation complex. Front Biosci (Landmark Ed). Jan 1;17:1517-32.
- Wurn S et al. 2015. Terminal epidermal differentiation is regulated by the interaction of Fra-2/AP-1 with Ezh2 and ERK1/2. GENES & DEVELOPMENT 29:144–156; doi/10.1101/gad.249748.114.
- Oh IY et al. 2014. Regulation of the Dynamic Chromatin Architecture of the Epidermal Differentiation Complex Is Mediated by a c-Jun/AP-1-Modulated Enhancer. Journal of Investigative Dermatology 134, 2371–2380; doi:10.1038/jid.2014.44.
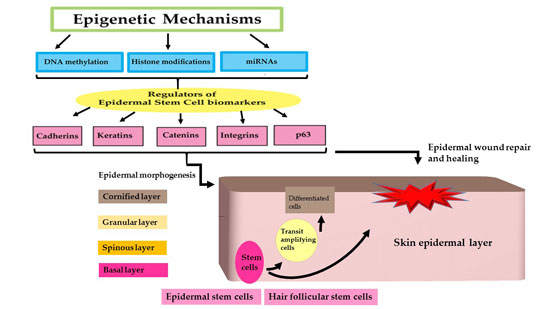
Imagen tomada de Saldanha et al 2016 Int J Mol Sci. 2015 Dec 24;17(1). pii: E16. doi: 10.3390/ijms17010016.
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998