He invitado al Dr Alexis García a escribir en mi Sección Dermatitis de Contacto para que nos hable de un tema actual y cambiante del cual estamos aprendiendo cada día. La Inmunopatología de Covid 19, enfermedad producida por el coronavirus Sars-CoV-2 causante de la grave pandemia en nuestro planeta. El Dr García es médico egresado de la Universidad Central de Venezuela (UCV) con post grado en Pediatría y Puericultura en el Hospital “J M De Los Ríos” y Maestría en Inmunología Clínica en el Instituto de Inmunología de la UCV. Se ha desempeñado como Director Médico de Glaxosmithkline desde el 2002 hasta el 2014 y como asesor médico del mismo laboratorio farmacéutico desde 1999 hasta el 2002. Ha participado en consenso VIH/SIDA, en el Plan Ampliado de inmunización de la vacuna del Rotavirus en Latinoamérica y otros consensos de diferentes patologías. Actualmente es Profesor Asistente y Coordinador de Extensión del Instituto de Inmunología UCV. Colabora con el postgrado de Farmacología de la Facultad de Farmacia UCV y con las cátedras Materno Infantil y Semiología del Colegio Universitario “Jean Piaget”. Tiene trabajos publicados en el área de la inmunología.
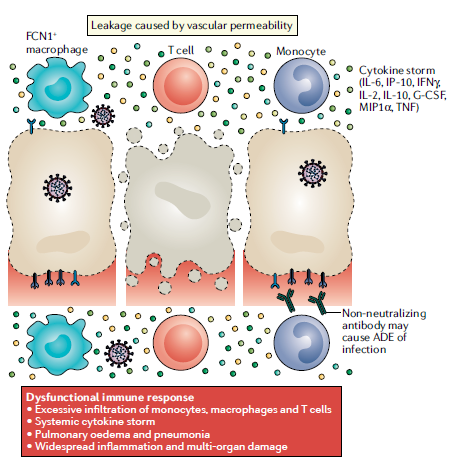
Figura tomada parcialmente del artículo de libre acceso que pueden conseguir en el siguiente enlace: https://www.nature.com/articles/s41577-020-0311-8.pdf
Los últimos estudios científicos en los campos de la genética, virología, inmunología y clínica con relación a la pandemia de COVID-19, una enfermedad causada por un nuevo coronavirus, SARS-CoV-2, sugieren un camino similar al del síndrome respiratorio agudo grave (SARS) y al síndrome respiratorio de oriente medio (MERS). La rápida secuenciación genómica, los nuevos hallazgos de la respuesta inmunológica ante el virus y los estudios clínicos en curso, nos están brindando de una forma acelerada más conocimiento sobre el patógeno en sí, incluida la respuesta inmune del huésped.
Se sabe que los coronavirus causan enfermedades en humanos y animales. Entre estos, cuatro (coronavirus humanos 229E, NL63, OC43 y HKU1) típicamente infectan solo el tracto respiratorio superior y causa relativamente síntomas menores. Sin embargo, hay tres coronavirus SARS-CoV, MERS-CoV y SARS-CoV-2, que pueden replicarse principalmente en el tracto respiratorio inferior y causar neumonía; otros órganos y tejidos también pueden ser afectados, el desenlace puede ser fatal. El SARS- CoV-2 pertenece al género betacoronavirus, su pariente más cercano entre humanos los coronavirus son SARS-CoV, con un 79% de similitud genética. Sin embargo, entre todas las secuencias de coronavirus conocidas, SARS-CoV-2 es más similar al coronavirus de murciélago RaTG13, con un 98% de similitud y secuencias de coronavirus en el pangolín (un oso hormiguero escamoso) también comparte una gran similitud. Al igual que los otros coronavirus, el SARS-CoV-2 se transmite principalmente a través de gotitas saliva, con una posible, pero no comprobada, vía de transmisión fecal-oral. El período de incubación es de aproximadamente 4 a 5 días antes del inicio de los síntomas.
Los pacientes con COVID-19 generalmente presentan fiebre y tos seca, con menos frecuencia pueden presentar dificultad respiratoria, mialgias, artralgias, cefalea, diarrea, náuseas y erupción cutánea. Los casos graves de COVID-19 progresan al síndrome de dificultad respiratoria aguda (SDRA), en promedio alrededor de 8 a 9 días después del inicio de los síntomas. La fisiopatología de la infección por SARS-CoV-2 se parece mucho a la infección por SARS-CoV, con una respuesta inflamatoria exagerada que conlleva al daño de las vías respiratorias y otros tejidos. Por lo tanto, la gravedad de la enfermedad en los pacientes con COVID-19, no solo se debe a la infección viral, sino también, a la respuesta del huésped. El patrón de aumento de la gravedad relacionada con la edad, es ampliamente consistente con la epidemiología de SARS- CoV y MERS- CoV.
La infección por SARS-CoV-2 y la destrucción de las células que infecta (principalmente células del epitelio pulmonar) desencadena una respuesta inmune local, reclutando macrófagos y monocitos que responden a la infección, liberan citocinas y preparan la respuesta inmune adaptativa de células T y B. En la mayoría de los casos, este proceso es capaz de resolver la infección. Sin embargo, en algunos casos, se produce una respuesta inmune disfuncional, que puede causar un grave daño pulmonar e incluso sistémico. Los virus con efectos citopáticos, como el SARS-CoV-2, inducen la muerte y lesiones de las células y tejidos infectados como parte del ciclo de replicación del virus. La infección viral y la replicación en las células epiteliales de las vías respiratorias podrían causar altos niveles de piroptosis ligada al virus con fuga vascular asociada, como se observa en pacientes con SARS-CoV.
La piroptosis, es una muerte celular programada de tipo inflamatoria, dependiente de la enzima caspasa-1, la cual está asociada con una respuesta durante la inflamación y tiene características tanto de la apoptosis y de la necrosis, como la fragmentación del ADN; aunque no conduce a la ruptura de la membrana plasmática, si ocurre la liberación de citocromo C y la activación de la enzima caspasa-3, además del edema de la célula, la formación de poros y la lisis celular así como la liberación de la caspasa-1. Este es un desencadenante probable de la respuesta inflamatoria posterior. La IL-1?, una citocina importante liberada durante la piroptosis, se eleva durante la infección por SARS-CoV-2.
Usando una variedad de receptores de reconocimiento de patrones (PRRs), las células epiteliales alveolares y los macrófagos alveolares detectan los patrones moleculares asociados a patógenos liberados (PAMPs), tales como ARN viral y patrones moleculares asociados al daño (DAMPs). Se produce una ola de inflamación local, que involucra aumento de la secreción de las citocinas proinflamatorias y quimiocinas, tales como IL-6, IFN?, MCP1 e IP-10 en la sangre de pacientes afectados. Estas citocinas son indicadores de una respuesta polarizada de los linfocitos T cooperadores Tipo 1 (TH1). La secreción de tales citocinas y quimiocinas atrae células inmunes, en particular monocitos y Linfocitos T, pero no neutrófilos, de la sangre al sitio donde se localiza la infección. El reclutamiento de las células inmunes de la sangre periférica hacia los tejidos afectados, principalmente el epitelio pulmonar, puede explicar la linfocitopenia que se observa en los pacientes con COVID-19.
En la mayoría de los individuos, las células reclutadas eliminan la infección en el pulmón y otros órganos afectados, lo que conlleva a una regulación y disminución de la respuesta inflamatoria con recuperación de los pacientes. Sin embargo, en algunos pacientes, se produce una respuesta inmune disfuncional, que desencadena una tormenta de citoquinas que media la inflamación pulmonar generalizada. Los niveles de IL-6 en estos pacientes continúan aumentando con el tiempo y son relativamente más elevados en los no sobrevivientes que en los sobrevivientes.
Además, los pacientes con enfermedad grave muestran un porcentaje significativamente mayor de monocitos inflamatorios CD14 + CD16 + en sangre periférica que los pacientes con enfermedad leve. Los mecanismos por los cuales el SARS-CoV-2 evade la respuesta de citocinas antivirales innatas del cuerpo, aún no se ha aclarado en su totalidad, pero la investigación en pacientes con SARS-CoV muestra que múltiples proteínas virales estructurales y no estructurales antagonizan las respuestas al interferón. El antagonismo de la respuesta al interferón ayuda a la replicación viral, lo que resulta en una mayor liberación de productos de piroptosis que amplifican una respuesta inflamatoria aberrante. La infiltración celular inflamatoria sin restricciones puede mediar el daño en el pulmón y de otros tejidos a través de la secreción excesiva de proteasas y especies reactivas de oxígeno, aunado al daño directo causado por el virus. Además del daño local, la tormenta de citoquinas también tiene efectos sistémicos. Los niveles elevados de citocinas como el TNF puede causar shock séptico y falla multiorgánica.
Los análisis del tejido pulmonar de los pacientes que fallecieron con COVID-19 mostraron los siguientes hallazgos: congestión capilar, necrosis de neumocitos, membrana hialina, edema intersticial, hiperplasia de neumocitos y atipia reactiva, trombos de plaquetas y fibrina. El infiltrado inflamatorio estaba compuesto por macrófagos en los lúmenes alveolares y linfocitos principalmente en el intersticio. La microscopía electrónica reveló partículas virales en el citoplasma de los neumocitos.
Conclusión
La pandemia de COVID-19 es un grave problema en curso. Sin intervenciones terapéuticas concluyentes y sin una vacuna, las estrategias actuales se basan es reducir la propagación del virus y proporcionar atención de apoyo a los pacientes enfermos. Comprender la respuesta inmunológica contra la infección por el SARS-CoV-2 nos permitirá investigar y desarrollar terapias dirigidas. Controlar la respuesta inflamatoria es tan importante como inhibir la replicación viral. Se necesitan más estudios sobre la respuesta inmune del huésped al SARS-CoV-2, incluida la investigación detallada de esta respuesta en pacientes asintomáticos o con enfermedad leve a moderada versus aquellos pacientes que evolucionan a las formas graves de la enfermedad. Esto ayudaría a identificar biomarcadores para definir correlatos inmunes de protección y gravedad.
- Alicia Schwartz. In the Eye of the Storm. Home Healthc Now May/Jun 2018; 36(3):205-206. Doi: 10.1097/NHH.0000000000000675.
- Xi-Zhi J Guo, Paul G Thomas. New Fronts Emerge in the Influenza Cytokine Storm. Semin Immunopathol. 2017 Jul; 39(5):541-550. Doi: 10.1007/s00281-017-0636-y
- Chousterman BG, Swirski FK, Weber GF. Cytokine Storm and Sepsis Disease Pathogenesis. Semin Immunopathol. 2017 Jul; 39(5):517-528. Doi: 10.1007/s00281-017-0639-8.
- Koichi Yuki, Miho Fujiogi, and Sophia Koutsogiannaki. COVID-19 pathophysiology: A review. Clin Immunol. 2020 Apr 20: 108427. Doi: 10.1016/j.clim.2020.108427.
- Matthew Zirui Tay , Chek Meng Poh , Laurent Rénia , Paul A MacAry , Lisa F P Ng. The Trinity of COVID-19: Immunity, Inflammation and Intervention. Nat Rev Immunol . 2020 Apr 28. doi: 10.1038/s41577-020-0311-8.
- Luca Carsana, Aurelio Sonzogni, Ahmed Nasr, Roberta Rossi, Alessandro Pellegrinelli, Pietro Zerbi, Roberto Rech, Riccardo Colombo, Spinello Antinori, Mario Corbellino, Massimo Galli, Emanuele Catena, Antonella Tosoni, Andrea Gianatti, Manuela Nebuloni. Pulmonary post-mortem findings in a large series of COVID-19 cases from Northern Italy. doi: https://doi.org/10.1101/2020.04.19.20054262.
- Eakachai Prompetchara, Chutitorn Ketloy, Tanapat Palaga. Immune Responses in COVID-19 and Potential Vaccines: Lessons Learned From SARS and MERS Epidemic. Asian Pac J Allergy Immunol. 2020 Mar; 38(1):1-9. Doi: 10.12932/AP-200220-0772.
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
