Invitamos a la bioanalista Orquídea L. Rodríguez a escribir esta Editorial sobre una de las alternativas terapéuticas más prometedora para eliminar al melanoma.
o – o – o
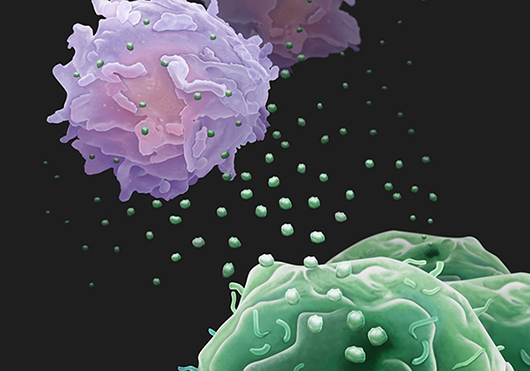
Las células NK son miembros de las células linfoides innatas (ILC) que han emergido como una opción prometedora en la inmunoterapia contra el cáncer, debido a su habilidad única de distinguir y eliminar células transformadas o tumorales sin sensibilización previa (1). Utilizan un conjunto de receptores activadores (ej. NKG2D/CD314, NCRs, CD16) e inhibidores (ej. KIR/CD158, NKG2A/CD159a) que les permite reconocer la expresión de proteínas alteradas para luego destruir células estresadas como los melanocitos premalignos y desarrollar una respuesta antitumoral dentro del microambiente tumoral (TME) antes de que aparezca el melanoma clínico sin la necesidad de sensibilización previa a antígenos específicos (2,3). Forman sinapsis inmunológicas con las células diana y liberan gránulos citolíticos preformados, como perforina y granzimas. La perforina causa la perforación de la membrana de la célula objetivo, lo que permite que la granzima ingrese a la célula e induzca la apoptosis y lisis celular.
Las estrategias terapéuticas basadas en células NK contra tumores sólidos han sido aplicadas con un éxito modesto, debido a la capacidad de las células tumorales para escapar de la vigilancia inmunológica, proliferar rápidamente y lograr la metastasis cuando se combina con las anomalías en las Células NK como la expresión disminuida de receptores activadores o sobreexpresión de receptores inhibidores, producción defectuosa de citocinas, moléculas de señalización intracelular anormales, tráfico ineficaz al sitio del tumor y senescencia, resultando en una respuesta citolítica defectuosa (4,5). Algunos autores han propuesto estrategias para superar estos problemas en el melanoma: agregar estimulantes inmunes para producir efectos sinérgicos, realizar la transferencia adoptiva de células NK expandidas in vitro o modificadas genéticamente para que sean más fuertes y resistentes, y por último, la transferencia de nano vesículas secretadas por las células NK conocidas como vesículas extracelulares (EVs) que han cobrado atención por sus aplicaciones en terapias contra el cáncer (1,6).
Las EVs son partículas liberadas por las células que están delimitadas por una bicapa lipídica, no pueden replicarse y son producidas como mecanismo de comunicación paracrina/endocrina. Según su origen y tamaño se han diferenciado en exosomas (70-150 nm, origen endosomal) y microvesículas (150-1000 nm, originadas de la membrana plasmática). Las EVs transmiten señales biológicas reguladoras mediante la transferencia de proteínas de membrana y citosólicas, lípidos, DNA mitocondrial y genómico, RNA mensajero (RNAm) y microRNA (miRNA) que regulan diversos procesos fisiológicos (6).
Las EVs derivados de células NK humanas (EVs NK) contienen marcadores típicos de NK (ej. CD56) y proteínas líticas (ej. FasL, perforina). Los primeros estudios empleando EVs NK mostraron que aquellas provenientes del cultivo de células NK purificadas, tuvieron efectos citotóxicos sobre líneas celulares hematológicas malignas, pero no sobre células de tumores sólidos (7), sin embargo, las EVs NK obtenidas de células NK activadas y expandidas in vitro, mostraron efectos citotóxicos significativos sobre líneas celulares tumorales, neuroblastomas y carcinomas de mama (8); lo cual sugiere que las células NK activadas pueden producir EVs con mayor actividad inmunitaria en comparación con las células NK vírgenes.
Investigaciones recientes en modelos de ratones han demostrado el efecto antitumoral de las EVs NK sobre el melanoma. Las EVs NK se aislaron por ultracentrifugación de un gradiente de densidad de una línea celular alogénica NK-92 y se inyectaron localmente en el melanoma, evidenciándose una inhibición significativa de la progresión del tumor (9).
La muerte de las células diana por EVs NK es producida por distintos mecanismos que incluyen la entrada mediada por perforina/granzima, la interacción mediada por receptor-ligando (Fas/TRAIR, FasL/TRAIL), fusión a la membrana plasmática y acción de la granulisina (10,11).
La capacidad para transferir cargas bioactivas (es decir, ácidos nucleicos, lípidos y proteínas) a las células receptoras o activar vías de señalización en las células diana, hace que las EVs sean consideradas como alternativas potenciales a la terapéutica basada en células, con características posiblemente superiores a las células en algunos aspectos: el tamaño nanométrico de las EVs permite su difusión pasiva a través de los tejidos, el ambiente ácido de los tumores sólidos promueve la fusión entre EVs y las células tumorales (por lo tanto, se minimiza la inmunosupresión creada en el TME), la capacidad para atravesar barreras biológicas como la barrera hematoencefálica y la barrera hematotumoral, la fácil conservación, almacenamiento y acceso como suministro inmediato (estables a -80 ° C, y duran hasta 12 meses) (1)
Orquidea L. Rodriguez
Bioanalista/Investigador Laboratorio de Biología Celular y Molecular, Instituto de Biomedicina “Dr. Jacinto Convit”. Profesor instructor Facultad de Medicina, Universidad Central de Venezuela
Referencias bibliográficas
- Hu W, Wang G, Huang D et al. Cancer Immunotherapy Based on Natural Killer Cells: Current Progress and New Opportunities. Front Immunol. 2019; 1205:1-16.
- Cristiani C, Garofalo C, Passacatini L et al. New avenues for melanoma immunotherapy: NK cells? NK cells and solid tumors immune therapy. Scand J Immunol. 2020; 91:128-161.
- Urbonas V, Smailyte G, Urbonaite G et al. Natural killer cell-based immunotherapy: a new fighter against melanoma?. Melanoma Res. 2019; 29: 208-211.
- Guillerey C, Huntington ND, Smyth MJ. Targeting natural killer cells in cancer immunotherapy. Nat Immunol. 2016; 17:1025–36.
- Vitale M, Cantoni C, Pietra G, et al. Effect of tumor cells and tumor microenvironment on NK-cell function. Eur J Immunol. 2014; 44:1582–92.
- Xie F, Zhou X, Fang M, et al. Extracellular Vesicles in Cancer Immune Microenvironment and Cancer Immunotherapy. Adv Sci (Weinh). 2019; 6(24):1901779.
- Lugini L, Cecchetti S, Huber V, et al. Immune surveillance properties of human NK cell-derived exosomes. J Immunol. 2012; 189:2833–42.
- Jong AY, Wu CH, Li J, et al. Large scale isolation and cytotoxicity of extracellular vesicles derived from activated human natural killer cells. J Extracell Vesicles. 2017;6:1294368.
- Zhu L, Kalimuthu S, Gangadaran P, et al. Exosomes derived from natural killer cells exert therapeutic effect in melanoma. Theranostics. 2017; 7:2732–45.
- Fais S. NK cell-released exosomes: natural nanobullets against tumors. Oncoimmunology. 2013; 2:e22337.
- Wen C, Seeger RC, Fabbri M, et al. Biological roles and potential applications of immune cell-derived extracellular vesicles. J Extracell Vesicles. 2017; 6:1400370.
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998

Excelente artículo Orquídea una nueva alternativa terapéutica podrán ser producidas de manera sintética? Para otros tipos de cáncer
, gracias
Excelente artículo José es asombrosos lo que observamos de la investigación, saludos antonio clemente h