Dr. Eusebio Plasencia.
Dra. Blanca Acosta,
M.Sc. Fernando Gómez Daza.
Servicio de Dermatología de la Ciudad Hospitalaria "Dr. Enrique Tejera". Valencia.
Paciente: R.M.
Tipo de piel: IV/VI Fitzpatrick.
Motivo de consulta: Placa descamativa localizada en el cuerpo.
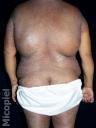
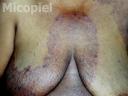
Enfermedad actual: Paciente de sexo femenino de 55 años de edad, natural y procedente de Valencia, Venezuela, quien presenta dermatosis generalizada bilateral y simétrica caracterizada por placa eritemato-violácea, descamativa, pruriginosa de bordes bien delimitados que se inicia en región inguinal y se extiende respetando cara, cuello, parte de glándulas mamarias y antebrazos de un año de evolución.
Fig.1
Fig.2
Fig.3
Caso presentado previo consentimiento del paciente.
Antecedentes familiares: Padre y madre con Diabetes mellitus tipo 2 e hipertensión arterial, cuatro hijos: dos con Diabetes mellitus tipo 2.
Antecedentes personales: Síndrome metabólico caracterizado por Diabetes mellitus tipo 2 diagnosticada hace 16 años con control irregular; hipertensión arterial hace 5 años; hiperlipidemia y obesidad mórbida. Refiere automedicación con esteroides locales.
Estudios paraclínicos:
-
Laboratorio: Glicemia en ayunas: 260 mg/dl; Hemoglobina Glicosilada: 12 %; Colesterol Total: 295 mg/dl; HDL Col: 28 mg/dl; LDL Col: 140 mg/dl; Triglicéridos: 350 mg/dl; Resto DLN.
-
Estudio micológico: En el examen directo con KOH 20% y tinta Parker® azul se observaron abundantes hifas hialinas segmentadas con artroconidias. Cultivo en agar Sabouraud y Mycosel® a temperatura ambiente crecimiento de colonias blanco-algodonosas a partir de los 4 días de incubación con pigmento rojo al reverso. En el estudio microscópico se observaron abundantes aleurioconidias unicelulares (microconidias) piriformes intercaladas.
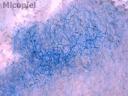
Fig. 4: Examen directo con KOH y tinta Parker® azul (100X)
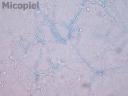
Fig. 5: Examen directo con KOH 20% y tinta Parker® azul, de talle (400X)
Fig. 6: Cultivo en agar Mycosel® a temperatura ambiente, 15 días de incubación
Fig. 7: Impronta del cultivo con cinta adhesiva transparente coloreado con azul de metileno en el que se aprecian abundantes aleurioconidias unicelulares (microconidias) piriformes intercaladas
-
Tratamiento: Sistémico: Terbinafina 250 mg VO OD por 90 días. Local: Emoliente BID. Referido a Medicina Interna quien indicó tratamiento para síndrome metabólico.
-
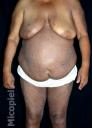
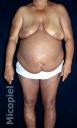
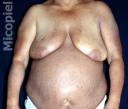
Evolución: A los tres meses se evidencia solo máculas hipercrómicas residuales en piel y franca mejoría de su niveles laboratoriales.
Fig. 8: Evolución a los 90 días de tratamiento
Fig. 9: Evolución a los 90 días de tratamiento
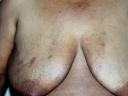
Fig. 10: Evolución a los 90 días de tratamiento
¿;Cuál el su diagnóstico, agente etiológico y alternativas terapéuticas?
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998




Tinea corporis extensa por la inmunosupresión por enfermedad de base (Síndrome metabólico) + automedicación con corticoides tópicos. En este caso el agente es T. rubrum, probablememte debe haberlo adquirido de otro miembro de la familia, ya que T. rubrum es antropofilo. La mejor opción terapeutica es la que ustedes usaron terbinafina oral, la otra alternativa es el itraconazol que en esta paciente diabetica y que de seguro le indicarian hipoglicemiantes orales se corria el riesgo de hipoglicemias por la interaccion microsomal con itraconazol.
Nuevamente te felicito!!!! Un caso de tinea corporis extensa por Tr. rubrum en paciente con inmunosupresión. El tratamiento fué el adecuado obteniéndose respuesta satisfactoria. Es aconsejable medidas de higiene y profilaxia que eviten las posibles recaidas y reinfección. Por ej. control y tto. de su diabetes, control y profilaxia de tinea pedis en el paciente y otros convivientes, etc.
El diagnóstico es tinea corporis y su agente etiológico Trichophyton rubrum. Este caso se presenta por la extensión de la placa que envuelve casi la totalidad de la piel glabra siendo el factor predisponente el síndrome metabólico que padece el paciente agravándose por la aplicación local de corticoides. Por el tipo de lesión se puede presumir clínicamente que el agente infectante es un dermatofito antropofílico, que se confirmó con el aislamiento del T. rubrum. Lo contrario sucede con los agentes geofílicos y zoofílicos que provocan una gran reacción inflamatoria produciendo pequeñas placas muy eritematosas. El determinar la forma de transmisión, es muy importante, para poder así realizar medidas profilácticas y evitar posibles recaídas. Con respecto al tratamiento es de hacer notar las interacciones que produce el Itraconazol con muchos medicamentos y especialmente, en este caso, con los hipogliceliamtes orales. El Fluconazol se puede utilizar pero en dosis mayores a las habituales, 150 mg cada 3 días, y la Terbinafina 250 mg VO OD. El tiempo de administración de estos medicamentos va a depender de la mejoría clínica y de controlar los factores predisponentes.
Msc. Fernando Gómez Daza
Lab. de Micología del Servicio de Dermatología
Ciudad Hospitalaria ¨Dr. Enrique Tejera¨. Valencia. Venezuela
[email protected]
58-241-8431360
58-416-7359639
Dr. Fernando Gómez Daza: Quería preguntarle si ud. tiene experiencia con el Clorazol Black, como colorante y aclarante en los exámenes micológicos directos. Aunque tengo años utilizándolo, no me acaba de convencer. Veo que con la utilización de KOH al 20%más tinta Parker azul, las hifas y esporas se definen muy bien en las fotos presentados por Uds. Hace muchos años utilicé solo el KOH al 20%, pero la preparación precipita muy rápidamente y hay que estar preparándola contínuamente. En ese sentido, la preparación de Clorazol Black, es más duradera.
También veo que utilizan azul de metileno y se obtiene muy buena definición.
Agradezco su opinión al respecto, porque quiero ensayar con otros colorantes para mis exámenes directos.
Un saludo cordial
Dr. Guillermo Planas Girón
Ccs-Vzla
Dr. Planas, no tengo experiencia con el Clorazol Black, se que clarifica y tiñe rápidamente y no hace falta calentar la preparación en comparación al hidróxido de potasio (KOH). Para que no se le precipite el KOH debe colocarlo en envase plástico, no de vidrio, las bases fuertes precipitan en ese tipo de recipientes. Para que las láminas duren hasta un día o dos debe agregar a la preparación del KOH, 10% de glicerina y así evitar un poco la desecación. Ejemplo KOH al 20%: 20 g de KOH, 90 ml de agua destilada y 10 ml de glicerina. Al colocar la gota de KOH a la muestra, también se le pude colocar una pequeña gota de tinta Parker® azul para posteriormente calentar a la llama y así acelerar la clarificación. Las estructuras fúngicas toman fuertemente el colorante a las horas, mi rutina es visualizarlas de nuevo a las 24 horas, de esa forma el procedimiento mejora la sensibilidad y se aprovecha para la toma fotográfica. En posteriores casos clínicos mostraré la visualización de un KOH a los pocos minutos y a las 24 horas para ver así la diferencia. Con respecto al azul de metileno lo utilizo solamente para las improntas con CAT visualizándola rápidamente debido a que con el paso de los minutos la cinta se va poniendo opaca. Esperando aclarar sus inquietudes se despide gustosamente
Msc. Fernando Gómez Daza
Lab. de Micología del Servicio de Dermatología
Ciudad Hospitalaria ¨Dr. Enrique Tejera¨. Valencia. Venezuela
[email protected]
58-241-8431360
58-416-7359639
Agradecido Dr.Gómez por su aporte que seguramente me será muy útile. El único incoveniente que veo con el KOH es tener que calentar la muestra. Eso implicaría tener un mechero de Bunsen en el consultorio. Ahora por lo que recuerdo hace muchos años, en el Instituto de Biomedicina, cuando observaba las muestras micológicas con KOH al 20%, no necesariamente las calentábamos, sin embargo veíamos las hifas. Tal vez el calor acelere, como Ud. lo dice, el aclaramiento de la muestra.
Reciba un saludo cordial
Dr. Guillermo Planas Girón
Ccs-Vzla
Dr. Planas, con un simple yesquero desechable es suficiente, sin pegar la llama al vidrio para evitar el hollín
OK. Gracias por los datos, que seguramente le serán muy útiles a los amigos lectores.
Saludos
Guillermo Planas Girón
Ccs-Vzla
Dr. Planas: claro que no se necesita «calentar» la muestra para visualizar las hifas en las preparaciones con KOH y/o tinta Parker, a menos que la muestra sea muy gruesa (por ej. uñas). Basta dejar actuar por unos pocos segundos o minutos, aplastar y observar al microscopio. Si no se tiene paciencia o tiempo, se puede esperar hasrta el día siguiente y como muy bien dice el Lic. Gómez Daza, la glicerina funciona muy bien para preservar las muestras de la desecación.