Enviado por:
Crespo L, Ramírez A, Blanco B, Zerpa O, Reyes O, Aranzazu N.
Instituto de Biomedicina Hospital Vargas Caracas Venezuela
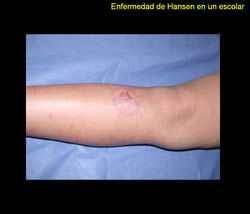
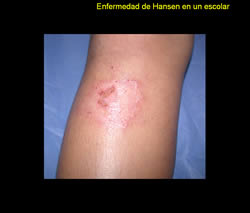
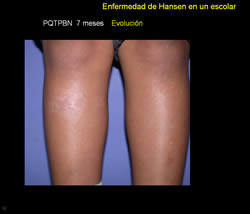
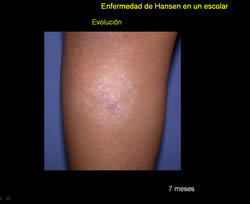
Se trata de paciente masculino de 9 años de edad, natural de San Casimiro quien refiere inicio de enfermedad actual 2 años previo a la consulta, cuando presenta placa eritemato-descamativa en pierna derecha, que había recibido tratamiento tópico con esteroides sin mejoría por lo que es referido a este centro en el año 2006.
 Antecedentes personales: asmático conocido, con crisis cada 6 meses. Había consultando múltiples facultativos, con diagnóstico presuntivo de dermatitis atópica y prúrigo , recibiendo antihistamínicos vía oral y lubricación.
Antecedentes personales: asmático conocido, con crisis cada 6 meses. Había consultando múltiples facultativos, con diagnóstico presuntivo de dermatitis atópica y prúrigo , recibiendo antihistamínicos vía oral y lubricación.
No reportaban historia familiar de enfermedad de Hansen.
Al examen físico llamó la atención el borde sobre elevado descamativo de la lesión por lo que se realizó examen directo micológico que resultó negativo. Además, zonas discretas de alopecia y al explorar sensibilidad la lesión era anestésica.
En el contexto de una placa anestésica en un escolar, se plantea el diagnóstico presuntivo de enfermedad de Hansen BT por lo que se realiza el siguiente plan:
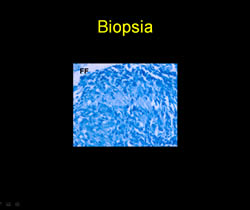
- Biopsia
- Estudio de linfas
- Test de discapacidad
Paraclínicos:
- Hematología completa:
GB: 6300 Neut 65%
HB 11,4 g/dl Hcto 34% plaq 356000
- VSG 42mm
- Química sanguínea: Glicemia,urea, creatinina: DLN
- Glucosa 6 fosfato deshidrogenasa DLN
- HIV negativo VDRL no reactivo.
Linfas
OD:0 OI:0
CD:0 CI:0
RD:0 RI:0
L:0
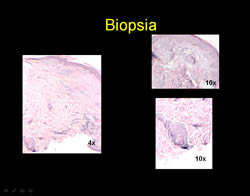
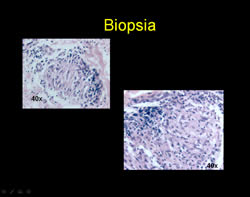
Ante la presencia de placa anestésica y hallazgos histopatológicos con un infiltrado que compromete anexos (glándulas sudoríparas, músculo piloerector) destruyendo un glomérulo sudoríparo y el músculo piloerector, con la presencia de macrófagos con diferenciación epitelioide se confirma diagnóstico de enfermedad de Hansen BT y se instaura tratamiento con poliquimioterapia paucibacilar niño (PQTPBN) con rifampicina y dapsona con una mejoría significativa de la lesión tras 6 meses de tratamiento.
Relatoria
La enfermedad de Hansen en niños entre 0 y 14 años, representa entre el 4-9% de los casos de Hansen reportados en la literatura, con una relación M:F de 2:1. En nuestro servicio , se han reportado 9 casos de Hansen en niños menores de 14 años en los últimos 5 años, con una edad promedio de 11 años, representando el 3,6% de los casos de Hansen reportados en dicho período. Se encuentra historia familiar de contacto de Hansen entre el 8-20% de los casos y la forma más común de presentación es la BT entre el 35-50% , es por ello que siempre debemos de recordar esta forma de presentación para poder incluirla dentro de los diagnósticos diferenciales de enfermedades comunes en la edad pediátrica como lo son la dermatitis atópica, pitiriasis alba y la tinea corporis siendo la exploración de la sensibilidad una herramienta fundamental al alcance de todos para poder llegar al diagnóstico de esta patología , que a pesar de no ser común, está presente en la población pediátrica.
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998

Ilustrativo caso de Hansen que nos enseña: 1) Que así como la Sífilis es la gran imitadora, le salió competencia con la E. de Hansen. 2) Que pensando en la enfermedad, con herramientas tan sencillas como un buen exámen neurológico de sensibilidad cutánea, el cual puede ser practicado hasta en una remota selva cercana a San Fernando de Atabapo, como lo comenté en unas de mis intervenciones en el Blog, podremos orientarnos hacia un Dx. probable.
En el FF que muestran los distinguidos colegas, salvo la inflamacion granulomatosa epitelioide, no se observan bacilos, hallazgo que es muy difícil encontrar en esta variedad de Hansen.
Me voy a referir sucintamente a un adolescente que vimos en el Servicio de Dermatopatología del I.B. Masculino de 12 años, con mancha vitiligoide retro-maleolar de 3 cm. de diámetro, solitaria, cuya biopsia demostraba un «escuálido» infiltrado linfocitario, casi insignificante, peri-neural (un foco), con una histología muchísimo menos florida que la presentada por Uds. Escasos linfocitos intra-neural. Ante nuestra insistencia, solo los CORTES SERIADOS, lograron demostrar la presencia de UN BACILO AAR y así hacer el Dx. La clínica demostró discreta disestesia.
!La semiología médica (dermatológica)!, mis apreciados ponentes, Dr. Crespo L y col. que a veces se nos olvida o no la aplicamos.
Igualmente sucede con los contactos….cuestión de anamnesis.
Felicitaciones por el caso.
Saludos cordiales. Dr. Guillermo Planas Girón
Caracas-Vzla.
Mis saludos y felicitaciones al equipo de trabajo de éste caso tan bien relatado amen de lo docente, y muy especialmente a mis mentoras en mi preparación en lepra y leishmaniasis, mi comentario es dirigido al aspecto epidemiológico de ésta enfermedad, si bien no se conoce un contacto intradomiciliario seria importante tomar en cuenta que existen también los llamados bolsones o zonas hiperendémicas, en donde se puede presentar lo denominado como “Transmisión Comunitaria”, por lo que se puede plantear el estudio epidemiológico tipo rastreo, con elaboración de mapas temáticos y georeferencias de casos conocidos y casos nuevos durante el estudio. De ésta manera se podría conocer la realidad de la enfermedad en la comunidad del paciente.
La intervención del Dr. Neudo E. Matos P, con su interesante enfoque epidemiológico, me permite plantearles al grupo de amigos expertos en Hansen del IB y al mismo Dr. Matos, algunas inquietudes cuyas respuestas esoy seguro, interesarán al resto de participantes y lectores del Blog.
1) Tengo entendido que la adquisición de la enfermedad se debe a contacto directo, frecuente y prolongado en el tiempo, bien sea domiciliario y/o con personas que frecuentemente visitan al afectado. Si hay algun otro factor epidemiológico nuevo, obviando las consideraciones inmunológicas, les agradezco me lo hagan saber.
2) De los pocos casos, quizás 8 o 10 pacientes que he tenido la oportunidad de ver en mi ejercicio profesional privado, derivados a Nacarid Aranzazu, todos tenían un contacto domiciliario claramente establecido, la mayoría de personal doméstico que trabajaban en casa de familias, provenientes de paises sureños. Me pregunto si no habrá una sub-estimación epidemiológica en la relatoria de las cifras presentadas por nuestros amigos expertos en el sentido de que «se han registrado en el Servicio del I.B, 9% de casos de Hansen en niños menores de 14 años en los últimos 5 años» y «con una historia familiar de contacto de 8-20% en el mismo lapso»
3) Agradecería ampliar un poco el concepto epidemiológico de «Transmisión Comunitaria» y si a través de esa exploración, no se podría alcanzar cifras mayores de contacos intradomiciliarios ?
Saludos cordiales,
Dr. Guillermo Planas Girón
Ccs-Vzla.
Saludos cordiales, a todos los visitantes del blog, mi referencia anterior sobre “Transmisión Comunitaria” no cambia los mecanismo clásicos de infección de la hanseniosis (como bien lo ha explicado el Dr. Planas, sigue siendo la vía respiratoria, y el contacto directo, les puedo referir al trabajo “Recombinant Mycobacterium leprae protein associated with entry into mammalian cells of respiratory and skin components.” Sato N, Fujimura T, Masuzawa M, Yogi Y, Matsuoka M, Kanoh M, Riley LW, Katsuoka K. Department of Dermatology, Graduate School of Medical Science, Kitasato University, 1-15-1 Kitasato, Sagamihara, Kanagawa 228-8555, Japan. Donde amplían lo sabido de la transmisión de la lepra). Transmisión comunitaria es un término epidemiológico utilizado para referirse al comportamiento de las enfermedades infectocontagiosas como la lepra, que en circunstancias de diagnóstico de casos en menores de 15 años, sin antecedentes familiares comprobables, hay que sospechar la existencia de casos multibacilares en el ambiente social y comunitario del caso índice, lo que nos permitiría encontrar los bolsones, o zonas con hiperendemias no conocidas hasta ese momento, como lo descubrieron en Cojedes y Portuguesa el equipo de trabajo de esas zonas conjuntamente con la Dra. Nacarid Aranzazu. Por lo que tendríamos que estudiar a la comunidad, y determinar cual es la fuente de infección, como se leer en la referencia bibliográfica, puede deberse a la cepa circulante en la zona, existe un trabajo de investigación muy bien llevado por el Dr. Alberto Panni y nuestro Maestro el Dr. Convit, donde se esta tipificando al Mycobacterium leprae en Venezuela, observado que existen variaciones en algunos Estados. Mi experiencia de 17 años en el Servicio de dermatología Sanitaria en el Estado Apure, donde hemos observado casos de diferentes formas clínicas, desde PB. (en su mayoria) hasta MB (8 caso )en niños, confirman los datos aportados por mis Profesoras, que de seguro provienen de uno de los mejores epidemiólogos de Venezuela; el Dr. Rafael Borges. Me parecería oportuna la aportación que maneja el Dr. Eusebio Plasencia en el servicio de Carabobo, por ser una fuente confiable del dato base, y además si mal no recuerdo presento una evaluación de Hansen en edades pediátricas en el congreso nacional de Dermatología el año pasado, donde recoge la revisión de 10 años de la enfermedad en edades pediátricas.
Espero que mi aclaratoria le sea de utilidad a los participantes.
Agradecido Dr. Matos por su ampliación de aspectos epidemiológicos del Hansen, por su aporte del dato bibliográfico de los autores japoneses y las investigaciones en marcha sobre la tipificación del ML y sus posibles variantes en Venezuela. Sería interesante leerse el trabajo del Dr. Eusebio Plasencia, en Carabobo, sobre Hansen en edad pediátrica.
Saludos cordiales,
Dr. Guillermo Planas Girón
Caracas-Venezuela
Estimado Dr. Matos: Mucho le agradecería chequear los datos exactos (no incluye el año de la publicación) de la referencia de los autores japoneses, para poderla solicitar.
Gracias anticipadas.
Dr. Guillermo Planas G.
Pido disculpas por la corta información de la literatura, esta es la información completa, incluye el resumen del estudio.
1: J Dermatol Sci. 2007 May;46(2):101-10. Epub 2007 Feb 20. Links
Recombinant Mycobacterium leprae protein associated with entry into mammalian cells of respiratory and skin components.Sato N, Fujimura T, Masuzawa M, Yogi Y, Matsuoka M, Kanoh M, Riley LW, Katsuoka K.
Department of Dermatology, Graduate School of Medical Science, Kitasato University, 1-15-1 Kitasato, Sagamihara, Kanagawa 228-8555, Japan.
BACKGROUNDS: The transmission of Mycobacterium leprae, the causative pathogen of leprosy, has been postulated to occur mainly through upper respiratory route rather than skin-to-skin contact via minor injuries. The M. leprae genome contains mce1A gene, which encodes a putative mammalian cell entry protein. However, to date, there have been no functional analyses of the M. leprae mce1A gene product. OBJECTIVE: The aim of this study was to elucidate a possible relationship between this transmission mechanism and the mce1A gene product. METHODS: We analyzed the cell uptake activity in vitro of polystyrene latex beads coated with a purified recombinant (r-) protein expressed by a 849-bp locus within the mce1A gene. RESULTS: The r-protein promoted uptake of the beads into human nasal epithelial cells derived from nasal polyps, human bronchial epithelial cell line, normal human dermal fibroblasts, normal human microvascular endothelial cells and normal human keratinocytes cultured at 0.01mM extracellular calcium concentration [Ca]; no uptake occurred with keratinocytes cultured at 1.2mM [Ca]. CONCLUSION: These results suggest that the mce1A gene product can mediate M. leprae entry into respiratory epithelial cells as their natural target cells, which may be the main mode of transmission. Endothelial cells, on the other hand, may serve as the reservoir of the bacilli for long-term infection. The M. leprae Mce1A protein has potential important implications for mode of transmission and pathogenesis of leprosy.
PMID: 17317107 [PubMed – in process]