Dra. Lídice Dufrechou
Dermatóloga, Ex Residente de la Cátedra de Dermatología del Hospital de Clínicas Facultad de Medicina, Universidad de la República
Dra. Alejandra Larre Borges
Prof. Adjunta de la Cátedra de Dermatología del Hospital de Clínicas Facultad de Medicina, Universidad de la República. Montevideo Uruguay
Resumen
Las drogas inmunosupresoras son utilizadas a largo plazo en pacientes receptores de trasplante con el fin de controlar la respuesta inmunológica del huésped contra el órgano trasplantado o injerto. Esta terapéutica, si bien es responsable del éxito del trasplante, expone a dicha población a numerosas complicaciones médicas a largo plazo, entre las que se destacan las infecciones y las neoplasias. Desde el punto de vista dermatológico, se observan múltiples manifestaciones cutáneas que generan problemas diagnósticos, terapéuticos y sobre todo una gran repercusión en la calidad de vida de estos pacientes.
Presentamos aquí una revisión del espectro clínico que abarcan las dermatosis y lesiones cutáneas observadas con mayor frecuencia en los receptores de órganos sólidos, haciendo especial hincapié en las observadas en los receptores de trasplante renal.
Introducción
En los pacientes con insuficiencia renal crónica, el trasplante renal constituye hoy en día la mejor alternativa en cuanto al mejoramiento de su calidad de vida en comparación con otros métodos de sustitución de la función renal como la hemodiálisis o la diálisis peritoneal ambulatoria. 1 Desde 1960, aproximadamente medio millón de trasplantes han sido realizados en todo el mundo. 2 Según los datos de sobrevida para receptores de trasplante, se calcula una sobrevida a 5 años del 85% para receptores de riñón en los Estados Unidos. 3
En Latinoamérica y según datos recolectados en 20 países entre 1991 y 2006, el acceso a terapias de sustitución renal; es universal en Argentina, Brasil, Chile, Cuba, Puerto Rico, Venezuela y Uruguay. Puerto Rico, Uruguay y Chile son los países que presentan mayor prevalencia de dichas técnicas respectivamente. 4
Los trasplantes renales y renopancreáticos, gracias al mejoramiento de las técnicas quirúrgicas y el advenimiento de nuevas terapias inmunosupresoras han logrado un aumento indiscutible en la supervivencia y capacidad funcional de los receptores, a expensas de un aumento en la comorbilidad relacionada con la terapéutica post-trasplante, ya que implica una inmunosupresión a largo plazo y en la mejor de las circunstancias; de por vida.
La terapia inmunosupresora tiene como objetivo el control de la respuesta inmunológica del receptor contra el órgano trasplantado y como contrapartida expone a los receptores a múltiples complicaciones. Los protocolos actuales de inmunosupresión preconizan la utilización de terapias inmunosupresoras combinadas con el fin de minimizar la administración de corticoides así como lograr un efecto aditivo y sinérgico. 2 Los diferentes regímenes varían según el área geográfica y el centro de referencia, pero en términos generales las drogas inmunosupresoras utilizadas corrientemente por los equipos de trasplante son inhibidores de la calcineurina como ciclosporina, tacrolimus y tacrolimus MR; antimetabolitos como mofetil micofenolato y micofenolato sódico; e inhibidores de la m- TOR como sirolimus y everolius. 5, 6 Ciclosporina y tacrolimus son los más frecuentemente prescriptos, se puede incluir uno o más agentes aditivos o sustituyéndolos. Según las diferentes circunstancias y características individuales, pueden ser agregados prednisona, azatioprina, micofenolato y los inhibidores de la m- TOR. 5
Las complicaciones del trasplante a nivel general son quirúrgicas en una primera instancia y médicas a largo plazo. Pueden dividirse en precoces y tardías como se muestra en la tabla 1. El mayor riesgo de infecciones se presenta en el período post trasplante inmediato y perioperatorio (hasta 1 mes luego del trasplante), se extiende hasta los 6 meses después del mismo y persiste hasta tanto el paciente requiera concentraciones altas de inmunosupresores. 8, 9 Las complicaciones neoplásicas en general se ven a más largo plazo, se piensa son sub-reportadas y se calcula al menos un riesgo aumentado de 3 a 5 veces con respecto a la población general con edad y sexo similar 10.
Las lesiones cutáneas son de gran relevancia en los receptores de órganos sólidos (ROS), ya que entre el 45 al 100% de los pacientes trasplantados las presentan 2. Estas pueden dividirse en infecciones, neoplasias, efectos adversos de las drogas inmunosupresoras y miscelánea como se detalla en la tabla 2. Las manifestaciones cutáneas presentes en pacientes receptores del trasplante renal han sido estudiadas por varios equipos de investigación y puede resultar engorroso su análisis por las diferencias en las poblaciones y los diseños de los estudios. Presentamos aquí una revisión de las manifestaciones cutáneas más frecuentes en estos pacientes.
INFECCIONES
Las infecciones cutáneas son una complicación frecuente en los receptores de trasplante renal y renopancreático. Los microrganismos causales pueden ser considerados oportunistas, ya que se comportan como patógenos sólo en el huésped inmunodeficiente (ID), o son ordinariamente patógenos y tienen en los ID un curso inusualmente agresivo o diseminado.2 La frecuencia de infecciones cutáneas varía según los diferentes estudios entre un 27 y 66 % de frecuencia, pero éstos parecen coincidir en que los agentes causales son principalmente virus y hongos. 2, 11, 12, 13, 14, 15. Las verrugas vulgares ocasionadas por diferentes serotipos de VPH (Virus del Papilloma Humano) y las infecciones causadas por la familia de Herpesvirus junto con micosis superficiales como tiñas y la Pitiriasis Versicolor son las más frecuentemente encontradas. 11, 13, 14, 15 (Figs. 1, 2)
Los receptores tienen una probabilidad de desarrollar verrugas vulgares de 15-50% en el primer año post- trasplante y de 77 a 95% en los primeros 5 años. 16 Estas se presentan en forma múltiple (manos, pies y genitales) y tienen escasa respuesta al tratamiento 6, 15. La importancia de la infección viral también radica en su relación con la carcinogénesis ya que se ha detectado ADN de HPV en carcinomas espinocelulares, anogenitales y cervicales en mujeres, 10 así como Herpes virus 8 (HV8) en sarcomas de Kaposi 2, 17, 18. Por su parte, el Herpes simple se manifiesta de forma extensa, con necrosis, ulceración, evolución prolongada y mayor riesgo de diseminación hacia parénquimas nobles como el SNC, pulmones e hígado. 2, 15, 19, 20 Uno de los estudios más grandes de Mustapica Z et al. con respecto a la infección causada por el virus de la varicela zoster (VVZ) realizado con un total de 1139 pacientes receptores de trasplante renal entre 1972 y 2010 arrojó una frecuencia de 3,51% y una media de aparición de 2,13 años. El 95% de los pacientes estudiados presentó Herpes Zoster mientras que sólo un 5% presentó varicela.21 La distribución dermatomérica fue la forma de presentación clínica más frecuente. 21 El riesgo de desarrollo de Herpes Zoster parece aumentar con la edad al momento del trasplante 20, 22. Se aprecia en general un aumento del riesgo de diseminación, neuralgia post herpética y cicatrices en esta población. 20, 23
Con respecto a las infecciones fúngicas, como ya fue mencionado, las más frecuentes son las micosis superficiales, 11, 12, 13, 14, 15 que pueden ser predisponentes a la instauración de micosis profundas y en el caso de las micosis oportunistas como las producidas por Candida, éstas pueden ser de alto riesgo con riesgo elevado de morbilidad e invasión sistémica. 2Las más frecuentes son la pitiriasis versicolor 13, 15 según algunos estudios y las dermatofitosis según otros. 11, 14
Mientras que las infecciones bacterianas extracutáneas tienen gran relevancia en el período postrasplante inmediato 2, las piodermitis se reportan con menos frecuencia que las virales y las fúngicas y consisten en foliculitis y excepcionalmente ántrax. 11,13,14,15,19.
LESIONES MALIGNAS Y PREMALIGNAS
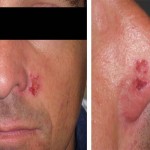
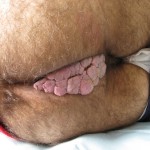
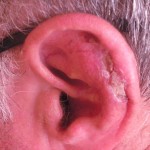
El cáncer de piel no melanoma es el cáncer más frecuente en pacientes trasplantados.3 La mayoría de las publicaciones muestra un incremento en el número de carcinomas espinocelulares en los receptores de órgano sólido que varía en incidencia de 1% a 6.5% en los 5 años después del trasplante y de 6% a 35% a los 10 años posteriores, 24 alcanzando entre un 30 a 70% en receptores de trasplante renal y dependiendo de la población estudiada25, 36. Se plantea un aumento del riesgo de carcinomas basocelulares de 10 veces con respecto a la población general y de 65 veces en el caso de los espinocelulares. 3, 11 Éstos se presentan con mayor agresividad, morbilidad, mortalidad y riesgo de metástasis.3, 27 A diferencia de lo que ocurre con la población general en la cual el carcinoma basocelular sobrepasa en incidencia al carcinoma espinocelular, la razón basocelular/espinocelular es inversa en los receptores de órgano, de manera que el carcinoma espinocelular es más frecuente en los pacientes transplantados con respecto al carcinoma baso celular.3, 8, 24, 28, 29 Sin embargo esta inversión en la frecuencia no se objetiva en todos los estudios y los autores lo atribuyen al corto tiempo postrasplante y escaso seguimiento. 11, 13
Se reconocen varios factores de riesgo para carcinoma espinocelular en los receptores de trasplante además de los propios de cada individuo. La edad avanzada en el momento del trasplante es uno de los predictores clínicos más importante de carcinoma espinocelular, 24, 26 y la mayor acumulación de radiación ultravioleta antes del trasplante implica un aumento del riesgo. 24, 26, 27 28 La localización preferencial de los carcinomas espinocelulares en áreas fotoexpuestas apoya el rol patogénico de la radiación ultravioleta así como el hecho de que éstos se presenten en áreas extensivas de daño actínico y displasia epidérmica conocidas como “campo de cancerización”.3 (Fig. 4) Numerosos estudios recientes utilizando reacción en cadena de polimerasa (PCR) reportaron alta prevalencia de DNA de HPV en los carcinomas cutáneos de pacientes transplantados (Fig. 3). 30 De hecho, las pacientes inmunocomprometidas tienen un riesgo 50 veces mayor de cáncer vulvar y 100 veces de cáncer anal comparados con la población general. 10 Además se han encontrado transcriptos E6/7 de HPV 8, 9, y 15 en queratosis actínicas y espinocelulares en estas pacientes. 3
Los pacientes con historia de carcinoma espinocelular diagnosticado y tratado antes del trasplante muestran un mayor riesgo de desarrollo de carcinoma espinocelular luego del mismo 27 por lo cual la historia de carcinoma espinocelular antes del transplante parece ser uno de los más fuertes predictores de subsecuentes carcinoma espinocelular. 24, 26
El carcinoma espinocelular se desarrolla con mayor frecuencia en pacientes con fototipo de Fitzpatrick tipo I, II y III así como en pacientes con ojos azules o claros y en pacientes de sexo masculino, siendo este último factor no coincidente en todas las investigaciones. 8, 24, 27, 31 (Fig. 5).
En cuanto a los factores étnicos, debemos destacar la diferencia de incidencia entre poblaciones de diferente raza que viven en una misma región geográfica. En Sudáfrica, el carcinoma espinocelular fue reportado solamente en pacientes pos trasplantados de raza blanca. 24La conjunción de factores como el tener piel clara y vivir en áreas subtropicales hacen que los individuos en éstas condiciones sean especialmente susceptibles al carcinoma espinocelular como es el caso de Australia. 27
Sin embargo, la inmunosupresión es el aspecto más crítico y relevante de los receptores de trasplante con respecto a la población general lo cual se explica por una reducción de la vigilancia antitumoral y sugiere un posible rol de las drogas en la carcinogénesis. 15, 32, 33. Además la duración y el nivel de inmunosupresión son conocidos factores de riesgo. 3
Varios estudios postulan que pacientes con planes de 3 fármacos inmunosupresores presentan mayor riesgo de cáncer de piel que pacientes en plan doble o sirolimus. 3
La azatioprina fotosensibiliza la piel frente a la radiación ultravioleta A (RUV-A). El DNA cutáneo de pacientes en dosis terapéuticas de azationprina contiene 6 tioguanina la cual es capaz de acelerar el proceso de carcinogénesis cutánea. 3, 8, 15, 33
Por su parte la cilcosporina ha demostrdo disminuir la reparación y apoptosis de los queratinocitos luego de radiación UVB llevando a la acumulación de DNA dañado mediante inhibición del sistema de reparación Nucleotide Excision Repatarion (NER). 8, 15, 32 Además, varios estudios demuestran la inhibición del poro de transición de permeabilidad de la membrana mitocondrial (mitocondrial permeability transition pore, MPTP). La apertura de este canal es inducida en presencia de stress oxidativo como el causado por la RUV llevando a la muerte celular. Sin embargo, en presencia de ciclosporina, las células dañadas sobreviven y son capaces de desarrollar carcinogénesis. 3, 34
Con respecto al melanoma, se plantea que los receptores de órgano tienen un riesgo aumentado de 3 a 8 veces de desarrollarlo con respecto a la población general 8, 35 pero los datos son controversiales dado que otros trabajos afirman un riesgo similar a los no receptores. 36 Los factores de riesgo para el mismo son similares a los de la población general. Se plantea además la influencia del sistema inmune en la biología de los melanocitos lo cual requiere mayor investigación al igual que el potencial rol de las mutaciones de BRAF en esta población. 3
Con respecto a otras neoplasias vale destacar la mayor incidencia de sarcoma de Kaposi en receptores de órgano sólido. Se piensa que el riesgo de desarrollar esta neoplasia es 500 veces mayor en pacientes receptores con respecto a la población general. 2, 17 La asociación entre el Herpes Virus Humano – 8 (HHV-8) y el sarcoma de Kaposi es clara en los pacientes trasplantados, si bien aún prevalece la duda en cuanto a si este tumor se produce por reactivación del virus a consecuencia de la inmunosupresión o a infección primaria transmitida vía órgano trasplantado. 18 El hecho de que la prevalencia de este virus sea mayor en determinadas áreas geográficas como el Mediterráneo y África supone una mayor frecuencia de sarcoma de Kaposi en receptores que provienen de dichas regiones. De hecho, se observaron 7 casos de sarcoma de Kaposi en 175 receptores de trasplante renal provenientes del centro y sur de Italia, en 10 años de seguimiento, con una seropositividad de 14,8 % para HHV- 8 para esa población. 18
En contraposición con estos resultados, en un total de 3815 trasplantes de órgano sólido realizados en 26 años, se identificaron tan solo 5 pacientes con sarcoma de Kaposi, lo cual correspondió a un 0,1% en población centro europea donde la prevalencia del HHV-8 es más baja. 17
EFECTOS ADVERSOS DE LAS DROGAS INMUNOSUPRESORAS
Los efectos adversos de las drogas inmunosupresoras (EADI) comprenden dermatosis altamente frecuentes en los receptores de trasplante renal y se calcula que las relacionadas al síndrome de Cushing se presentarían en un 55 a 90% de los receptores 13 estando estas especialmente relacionadas con afectación de la calidad de vida. 14
Lamayoría de los estudios coincide en que los EADI se observan con mayor frecuencia en la primera etapa pos trasplante por lo cual se relacionan con una alta carga de inmunosupresión y tienden a mejorar conforme avanza el tiempo. 13, 19
Las más frecuentemente citadas incluyen reacciones acneiformes, hipertricosis, hiperplasia gingival, estrías, hiperpigmentación cutánea, hirsutismo, púrpura y equimosis. 13, 14, 15, 19
Casi todas ellas se explican por la presencia de corticoides, ciclosporina y mofetil micofenolato 37, 38 por lo cual es difícil atribuir la responsabilidad a una sola droga. El hecho de que éstas disminuyan conforme lo hace la inmunosupresión y en especial los corticoides sugiere un mayor rol de estas drogas en la génesis de dichos efectos adversos.
Conclusiones:
En términos generales, la comparación entre los estudios disponibles es dificultosa debido a las diferencias entre las poblacionales estudiadas, los protocolos de inmunosupresión y el diseño de los mismos. Sin embargo, hay algunos conceptos que se desprenden de este trabajo de revisión. En primer lugar, los receptores de trasplante renal y renopancreático constituyen una población de riesgo dermatológico dada la alta frecuencia de dermatosis y lesiones cutáneas en esta población. Las principales afecciones tanto por su frecuencia como por su relevancia clínica son secundarias a la inmunosupresión a largo plazo y éstas son el aumento de las infecciones y las neoplasias y varían según la serie estudiada. Los efectos adversos de las drogas inmunosupresoras son máximos en las etapas de mayor inmunosupresión, reversibles y presentan repercusión fundamentalmente estética y por tanto en la calidad de vida de los pacientes.
El cáncer es una de las causas más importantes de muerte en receptores de trasplante con injerto funcionante. En particular, el carcinoma espinocelular muestra en esta población una alta prevalencia. Su presencia condiciona reiteradas cirugías y cambios en la estrategia de inmunosupresión, lo cual expone al paciente al riesgo de rechazo y repercute en su calidad de vida. La presencia de un especialista en dermatología en los equipos de trasplante ha demostrado generar mayor adherencia y conocimiento en cuanto a las medidas de fotoprotección y concientización a cerca del cáncer de piel.39 Es por este motivo que creemos importante el conocimiento y la participación de los Dermatólogos en el manejo de estos pacientes.
Bibliografía
1- Balboa O, Voelker R, Tchekmedyian V, et al. Análisis de la cirugía vascular del transplante renal. A propósito de 50 observaciones. Cirugía Uruguay 1986; 56:271. Disponible en: www.indt.edu.uy. Consultado: 10 de enero de 2010.
2- La Forgia MP. Manifestaciones cutáneas en receptores de órganos sólidos. Dermatol Argent 2006; 7 (2) 94:105.
3- O’Reilly Zwald F, Brown M. Skin cancer in solid organ transplant recipients: Advances in therapy and management. Part I. Epidemiology of skin cancer in solid organ transplant recipients. J Am Acad Dermatol 2011; 65: 253-261.
4- Cusumano AM, Gonzalez Bedat MC, García-García G, et al. Latin American Dialysis and Renal Transplant Registry: 2008 report (data 2006). Clin Nephrol 2010; 74(1): 3-6.
5- Vincent M, Parrott N, Lamerton E et al. Shared Care Guideline for Immunosuppression after Kidney and Pancreas Transplantation. Central Manchester University Hospitals. Disponible en: www.nyrdtc.nhs.uk. Consultado: 22 de mayo de 2012.
6- Shahidi S, Moeinzadeh F, Mohammadi M et al. Sirulimus- ased immunosuppression for treatment of cutaneous warts in kidney transplant recipients. IJKD 2011; 5: 351-353.
7- Martín P, Errasti P. Trasplante Renal. An Sist Sanit Navar 2006; 29 (2): 79-92.
8- De Pry JL, Reed KB, Cook-Norris RH et al. Iatrogenic immunosuppression and cutaneous malignancy. Clin Dermatol 2011; 29: 602–613.
9- Quindós G. Candidiasis, aspergilosis y otras micosis invasoras en receptores de trasplante de órgano sólido. Rev Iberoam Mocol 2011; 28(3): 110-119.
10- Hinten F, Meeuwis KAP, van Rossum MM et al. HPV-related (pre) malignancies of the female anogenital tract in renal transplant recipients. Crit Rev Oncol/Hematol; 2012 ARTICLE IN PRESS doi:10.1016/j.critrevonc.2012.02.008.
11- Formicone F, Fargnoli MC, Pisan F et al. Cutaneous Manifestations in Italian Kidney Transplant Recipients. Transplant Proc 2005; 37: 2527- 2528.
12- Lugo – Jener G, Sánchez JL, Santiago- Depin E. Prevalence and clinical spectrum of skin
diseases in kidney transplant recipients. J Am Acad Dermatol 1991; 24: 410-141.
13- Alper S, Duman S, Toz H et al: Skin diseases in Turkish renal transplant recipients. Inter J Dermatol 2005; 44: 939 – 941.
14- Sandoval M, Ortiz M, Díaz C et al. Cutaneous manifestations in renal transplant recipients of Santiago, Chile. Transplant Proc 2009; 41: 3752- 3754.
15- Dufrechou L, Larre Borges A, Nin M et al. Cutaneous Manifestations in 100 Renal and Reno-pancreatic Recipients of Uruguay. Transplant Proc 2011; 43: 3377–3379.
16- Martelli-Marzagão F, Yamashiro AS, Ogawa MM et al. Clinical and histopathological characterization and typing of the human papillomavirus in common warts of kidney transplant recipients. An Bras Dermatol 2010; 85(5):743-746.
17- Boeckle E, Boesmueller C, Wiesmayr S et al. Kaposi Sarcoma in Solid Organ Transplant Recipients: A Single Center Report. Transplant Proc 2005; 37: 1905–1909.
18- Cattani P, Capuano M, Graffeo R et al. Kaposi’s Sarcoma Associated with Previous Human Herpesvirus 8 Infection in Kidney Transplant Recipients J Clin Microbiol 2001; 39(2): 506–508.
19- Garay I, Ruiz Lascano A, Ducasse C et al. Manifestaciones cutáneas en pacientes receptores de trasplante renal. Dermatol Argent 2003; 9(5): 275- 283.
20- Tarvade SM, Shahapurkar A, Dedhia NM et al. Herpes zoster in renal transplant recipient- case report and review of the literature. Indian J Nephrol 2005; 15: 245-247.
21- Mustapica Z, Basic-Jukica N, Kesa P et al. Varicella Zoster Infection in Renal Transplant Recipients: Prevalence, Complications and Outcome Kidney Blood Press Res 2011; 34: 382-386.
22- Arness T, Pedersen R, Dierkhising R et al. Varicella zoster virus-associated disease in adult kidney transplant recipients: incidence and risk-factor analysis. Transpl Infect Dis 2008; 10(4): 260-268.
23- Jantsch J, Schmidt B, Bardutzky J et al. Lethal varicella-zoster virus reactivation without skin lesions following renal transplantation. Nephrol Dial Transplant 2010; 1-4.
24- Belloni Fortina A, Piaserico S, Alaibac M 2009. Squamous Cell Carcinoma. The SCOPE Collaborative Group (Eds). Skin cancer after organ Transplantation. Cancer treatment and research 146. Rosen T, Series Editor. Springer, pp 241-261.
25- Garg S, Carroll RP, Walker RG et al. Skin cancer surveillance in renal transplant recipients: re-evaluation of U.K. practice and comparison with Australian experience. Br J Dermatol 2009; 160: 177 – 179.
26- Ho WL, Murphy GM. Update on the pathogenesis of post-transplant skin cancer in renal transplant recipients Br J Dermatol 2008; 158: 217–224.
27- Ramsay H, Harden P, Reece S. Polymorphisms in Glutathione S-Transferases are Associated with Altered Risk of Nonmelanoma Skin Cancer in Renal Transplant Recipients: A Preliminary Analysis. J Invest Dermatol 2001; 117: 251-255.
28- Queille S, Luron L, Spatz A et al. Analysis of skin cancer risk factors in immunosuppressed renal transplant patients shows high levels of UV specific tandem CC to TT mutations of the p53 gene. Carcinogenesis 2007; 28(3): 724–731.
29- Jensen P, Hansen S, Moller B et al. Skin cancer in kidney and heart transplant recipients and different long-term immunosuppressive therapy regimens. J Am Acad Dermatol 1999; 40: 177–186.
30- Harwood CA, Surentheran T, McGregor JM et al. Human papillomavirus infection and nonmelanoma skin cancer in immunosuppressed and immunocompetent individuals. J Med Virol 2000; 61: 289–297.
31- Basset-Ségui N, Renaud- Vilmer C, Verola O. (2003) Carcinomas Espinocelulares. En: Encilcopedié Medico- Chirurgicale. Editions Scientifiques et Medicales Elservier SAS( 98-625-A-10), Paris: EMC.
32- Thoms KM, Kuschal C, Oetjen E et al. Ciclosporin A, but not everolius, inhibitsDAN repair mediated by calcineurin: implications for tumorigenesis under immunosuppression. Exp Dermatol 2010; 20: 232-236.
33- Athar M, Walsh AB, Kopelovich l et al. Pathogenesis of nonmelanoma skin cancer in organ transplant recipients. Arch Biochem Biophys 2011; 508: 159-163.
34- Norman KG, Canter JA, Shi M et al. Cyclosporine A suppresses keratinocyte cell death through MPTP inhibition in a model for skin cancer in organ transplant recipients. Mitochondrion 2010; 10 : 94–101.
35- Le Mire L, Hollowood K, Gray D et al. Melanomas in renal transplant recipients. Br J Dermatol 2006; 154(3): 472-477.
36- Dapprich DC, Weenig RH, Rohlinger AL et al. Outcomes of melanoma in recipients of solid organ transplant. J Am Acad Dermatol 2008; 59: 405-417.
37- Hengge UR, Ruzicka T, Schwartz RA et al. Adverse effects of topical glucocorticosteroids. J Am Acad Dermatol 2006; 54: 1-15.
38- Rosen J, Miner JN. The Search for Safer Glucocorticoid Receptor Ligands. Endocr Rev 2005; 26: 452–464.
39- Ismail F, Mitchell L, Casabonne D, Gulati A et al. Specialist dermatology clinics for organ transplant recipients significantly improve compliance with photoprotection and levels of skin cancer awareness. Br J Dermatol 2006; 155: 916–925.
ANEXOS
Figuras
Tablas


 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998





Excelente presentaciòn!
Si buscan en el ìndice principal arriba en còmo lo hago y se van al còmo lo hago 18 y 19 van a encontrar 2 casos de un mismo paciente, transplantado renal, en tratamiento con inmunosupresosres con mùltiples lesiones premalignas y malignas y el tratameinto de varias de ellas.
Aportan un material adicional a este extraordinario artìculo.
Pueden entrar en https://piel-l.org/blog/3942
Cordialmente,
Vito Abrusci