Alexis Mendoza-León, PhD.
El estudio de la comunidad microbiana (microbiota) y sus genes (microbioma) en el humano, a través del Proyecto Microbioma (https://piel-l.org/blog/16087),1 ha revelado su extrema importancia tanto en la salud humana como su relación con una variedad de enfermedades que involucran desordenes gastrointestinales al igual que extraintestinal, ej. enfermedades intestinales inflamatorias (IBD), infecciones intestinales recurrentes, colitis ulcerativa, obesidad, síndrome metabólico, alergias como asma, etc. La microbiota intestinal ha sido considerada como un ¨órgano¨ humano responsable de múltiples funciones fisiológicas que incluyen aspectos del metabolismo energético, así como el desarrollo y modulación del sistema inmune.
El beneficio establecido a través de la estrecha interrelación de la microbiota intestinal con su hospedero, puede ser interrumpido por distintos factores, por ej. dieta, influencia de antibióticos, alteraciones de la homeóstasis, variabilidad de la microbiota y alteraciones de señales inflamatorias, entre otros, generando los desordenes mencionados. Estudios recientes muestran que entre individuos sanos la microbiota difiere considerablemente, sin conocimiento hasta el momento de las razones de tal variabilidad.2 En términos clínicos, la potencial restitución de la microbiota nativa en el hospedero afectado mediante lo que se conoce como bacteroterapia o trasplante de microbiota intestinal (FMT: Trasplantación de microbiota fecal) obtenida de un individuo sano, representa una excelente oportunidad para el tratamiento de estos desordenes.3,4
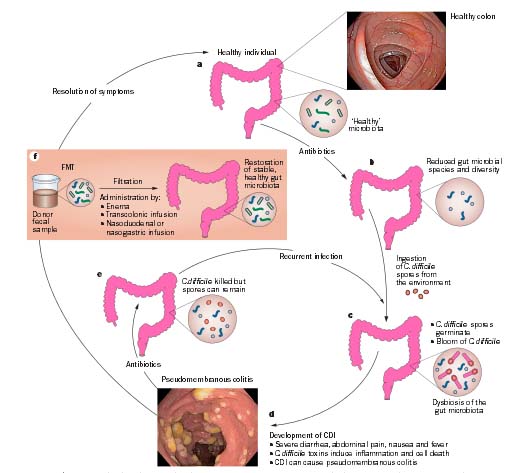
Un buen ejemplo para ilustrar lo anterior lo constituye la infección intestinal producida por Clostridium difficile, la cual ha visto incrementada su recurrencia en USA y Europa convirtiéndose en un problema de salud pública. El tratamiento clásico de la enfermedad es la administración de antibióticos, vancomicina o metroimidazol, lo cual genera una alteración de la microbiota del paciente afectado en relación a un individuo normal, por ej. se encuentra una reducción de especies microbianas del grupo Bacteroidetes e incremento en Protobacterias. Por otro lado, el prolongado tratamiento con el fármaco genera resistencia al mismo. Experimentos en pacientes con infección recurrente por C. difficile, o que muestran colitis pseudomembranosa, demuestran la efectividad de la FMT a través de la recuperación de la mayoría de estos pacientes. 5,6,7
La modulación de la interacción entre procesos metabólicos e inflamatorios en humanos a través de señales relacionadas con la microbiota, tiene importancia en enfermedades como diabetes y obesidad entre otras; el inflamasoma es un sensor intracelular de daño inducido por microorganismos (https://piel-l.org/blog/20429). FMT puede constituir una terapia promisoria para restituir condiciones apropiadas para el tratamiento de alguna de estas enfermedades en humanos.
A pesar del potencial que ha demostrado tener la FMT, algunas limitaciones son necesarias solventar. Aunque criterios para la selección de donante sanos de microbiota fecal se han establecido, existe una gran heterogeneidad entre la microbiota de estos individuos donantes al igual que en los receptores; tampoco ha sido establecido una metodología estándar en la incorporación de esta microbiota en los pacientes receptores, por ej. se ha utilizado infusiones en edemas, ruta nasal, o administración mediante colonoscopia. El futuro se muestra promisorio.
La imagen es de la referencia 4
Referencias
- Qin et al. 2010. http://goo.gl/gtT1e
- The Human Microbiome Project Consortium. http://goo.gl/AZCLs;http://goo.gl/LP3fB
- Wikipedia. http://goo.gl/Xmkd
- Borody T. & Khoruts. http://goo.gl/IbGg1
- Ethan Gough et al. 2011. http://goo.gl/EKwPX
- Els van Nood et al. 2013 http://goo.gl/dBOjT
- Gut microbiota. 2012. http://goo.gl/TjXxP
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998