Los organismos procariotas (Archaea y Bacteria) poseen un conjunto de mecanismos de inmunidad innata, que incluye endonucleasas capaces de cortar en sitios estratégicos el ADN de virus invasores, y metilasas que modifican a los mismos sitios en el ADN del procariota para protegerlo de la escisión, una estrategia conocida como sistema de modificación de la restricción (RM).
Cuando los procariotas son invadidos por virus, ellos pueden entrar en muerte celular programada o entrar en latencia, impidiendo así la propagación del virus en la bacteria o en una población bacteriana. En particular, cuando las bacterias son infectadas por virus pueden activar el sistema toxina- antitoxina (TA) que inducen la latencia o la muerte celular. Normalmente, la toxina se conjuga con la antitoxina, siendo ambos inactivados. Sin embargo, en condiciones de estrés, la antitoxina se degrada, la toxina se libera y daña a la bacteria.
Muchos virus que infectan bacterias también codifican sistemas RM y TA y contienen una variedad distinta de elementos genéticos móviles (MGEs) o trasposomas. Estos virus utilizan sistemas de RM para el mismo propósito que sus huéspedes procariotas: la metilasa modifica el genoma viral, mientras que las endonucleasas degradan cualquier genoma no modificado en la bacteria, proporcionando así los nucleótidos para la síntesis de nuevas copias del genoma viral. Además, el sistema TA puede asegurar la retención del virus dentro de la bacteria. El módulo TA que lleva el virus dentro de su genoma puede implantar un mecanismo de autodestrucción en su huésped, el cual se activa cuando se pierden o alteran los MGEs.
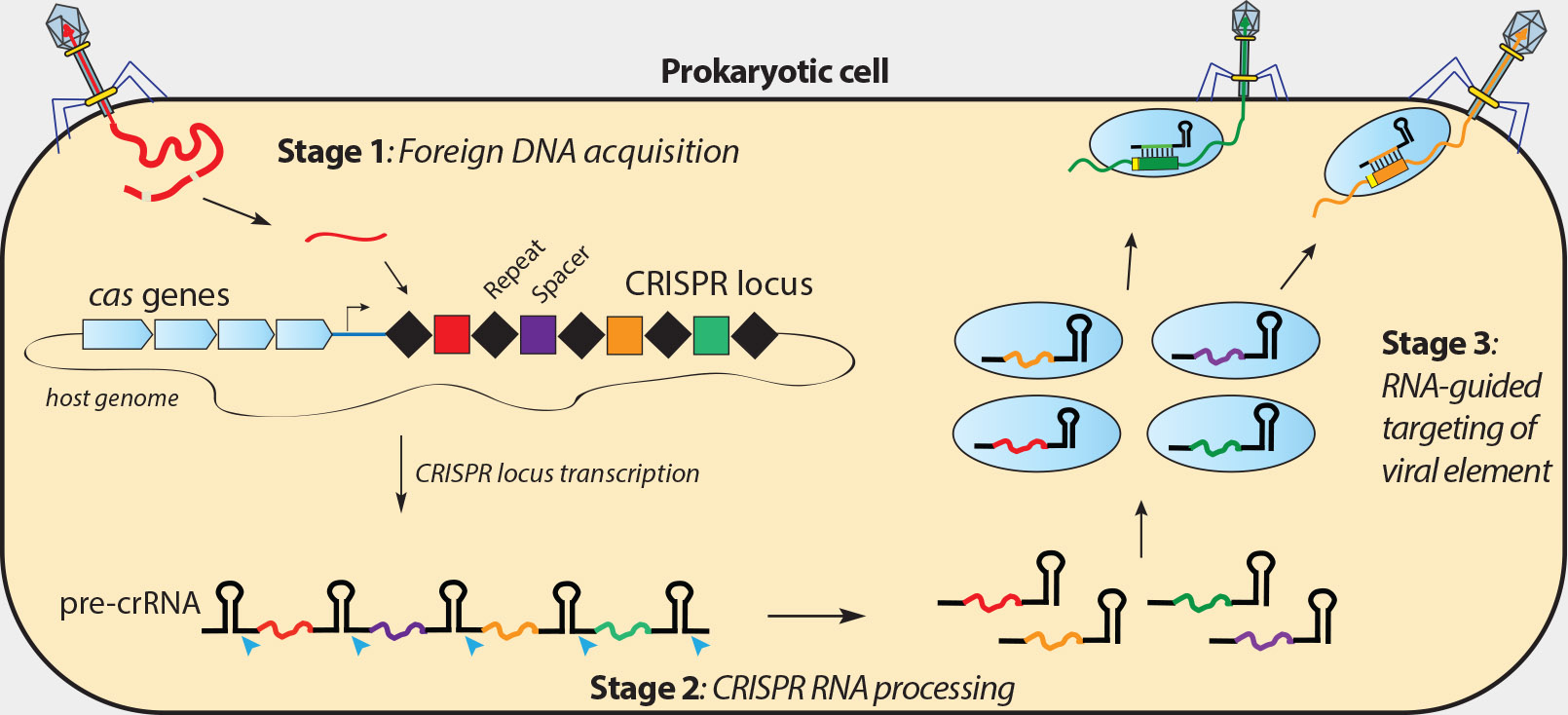
El MEG más conocido es el sistema Cas CRISPR, el cual confiere resistencia a elementos genéticos extranjeros, como plásmidos y bacteriófagos y así detener la transmisión adicional de fagos específicos, proporcionando una forma de inmunidad adquirida.
La manipulación en el laboratorio de Cas CRISPR y otros MEGs ha permitido realizar edición genómica, es decir, sustituir o reeditar a través de la inserción, reemplazo o remoción de secuencias génicas. Metodología que revoluciona la biomedicina al permitir corregir anomalías y enfermedades.
Cuando un MGE se inserta en el genoma del huésped y lo modifica, asegura la propagación del virus dentro del genoma del huésped. Dada la ubicuidad de los MGEs a través de las distintas formas de vida celular, se postula que evolutivamente los organismos huésped reclutaron estas herramientas de manipulación del genoma para sus propios fines. Una de ellos es la generación de memoria inmunológica –capacidad de guardar señales que le permitan frente a una segunda infección responder en una forma vigorosa y eficientemente contra el agente invasor- la cual implica la manipulación del genoma. Los MGEs y sus mecanismos de reparación y edición parecen haber contribuido con el origen de los animales y de las formas primarias de la inmunidad adaptativa.
Imagen es de The Doudna Lab – Jennifer A. Doudna – University of California, Berkeley, EUA
Lecturas Recomendadas:
- “CRISPR”, el editor genético que promete cambiar la medicina. Piel Latinoamericana Edición 386, 26 febrero 2016 https://piel-l.org/blog/41864.
- Edición genómica vs. Terapia genética.Piel Latinoamericana Edición 383, 26 febrero 2016 https://piel-l.org/blog/41487.
 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998

Excelente y muy didactico editorial. Gracias Felix por tu aporte!
Excelente !!
Qué interesante Félix!
No recuerdo si es que en el árbol de la vida los procariotas evolucionan hacia eucariotas cuando algún tipo de virus con ADN los invade y luego se descubren con la eventual membrana nuclear. similarmente bacterias pequeñas que invaden a esos organismos proveen mitocondrias cargadas de ARN. De esas invasiones resultan reproducción y metabolismo = vida. Claro que hoy en día hay formas de vida (cuestionables en su definición) con capacidad de alimentarse (de información) y multiplicarse dentro dude nuestras computadoras, como lo son los virus y gusanos cibernéticas. Gracias por tu clara y erudita exposición.
Existen ya algunas formas terapéuticas basadas en MEGs? Aunque sea en Fase I.
Desde que el Dr. Tapia publicara el corriente editorial no hago sino encontrar noticias y artículos sobre el tema.
Lo del CRISPR lo reporta Felix como algo de natural trascendencia entre los miles de avances diarios en inmunología y genética; pero la impresión que me da lo que he encontrado en otras fuentes, es la de que este es un avance tan significativo para la medicina como el descubrimiento de la penicilina. El potencial terapéutico del uso de CRISPS es enorme, no solo del punto de vista de lo que puede curarse, sino del que su costo no será el tan bárbaro del de otros agentes que trabajan a nivel molecular, como por ejemplo los agentes biológicos. Gracias al amigo Félix por presentarnos de manera tan ilustrativa y sencilla este descubrimiento en esta fase tan temprana.