
En el mundo de hoy que vivimos, es fácil pensar que cualquier cuadro febril con astenia, adinamia e hiporexia puede ser sinónimo de infección por SARS-CoV-2, la pandemia que actualmente viven todos los países del mundo. Incluso ya fue recientemente reportado el primer caso de reinfección por el virus, interrogando entonces la durabilidad de nuestros anticuerpos contra el mismo.
Hace dos semanas inicié con un cuadro febril, cuantificado VO entre 38.5-39°C, concomitante mialgias a predominio de ambos cuádriceps, astenia e hiporexia. No presenté clínica en piel hasta ese momento. Por supuesto que, ante la situación actual que vivimos, el primer diagnóstico que vino a mi lista de diferenciales fue el de COVID-19 (Coronavirus Disease-19). A las 12 horas de evolución presento acentuación de astenia, con disnea a moderados y grandes esfuerzos. Me examiné haciendo énfasis en lesiones de pies o algún rash que pasara por desapercibido o en mucosas y no había alteración evidente. Mis signos vitales dentro de lo normal, incluyendo oximetría de pulso que oscilaba entre 97-99% aire ambiente, excepto las cifras de tensión arterial que tenía tendencia a la baja. La clínica empeoró, asociándose cefaleas holocraneanas de fuerte intensidad con incluso fotofobia. Al terminar el efecto del acetaminofén, automáticamente iniciaban los síntomas y el empeoramiento de mi estado general. Nunca presente anosmia, odinofagia o disgeusia. Paralelamente a los síntomas, me interrogaba una y otra vez en qué parte del uso de mis equipos de protección personal (EPP), había fallado. ¿Dónde lo habría contraído? ¿Qué contacto con pacientes positivos había tenido?
Ante la alta sospecha de contagio, me realicé junto con mi hermano, médico residente de Cirugía General, el hisopado nasal para PCR de SARS-CoV-2. Debo destacar que la prueba es algo molesta y dolorosa. Me llamó la atención que mi hisopo, a diferencia del de mi hermano, había salido teñido escasamente con sangre. Él estaba asintomático y en buenas condiciones, sin embargo había referido 2 episodios aislados de cefalea holocraneana de moderada intensidad y en vista de que era mi único contacto, le realizaron también la prueba. Yo no descartaba que por ser personal de salud con múltiples horas a la semana de exposición, a pesar de su constante y riguroso uso de su EPP, él pudiera estarse comportando como un asintomático respiratorio. Automáticamente le dieron dos semanas de aislamiento en domicilio.
A las 72 horas de iniciar los síntomas, el patrón febril se mantenía igual, fijo cada 6 horas y con ello, la intolerancia a la vía oral, precedida de náuseas y un primer episodio de emesis de escaso contenido alimentario, por la marcada hiporexia. Posterior al mismo, evidencié automáticamente la aparición de petequias en ambas regiones malares, más no así en mucosa oral. Por lo anterior, mi hermano, procedió a cateterizarme una vía periférica radial derecha; automáticamente posterior a la colocación de torniquete, quizás unos pocos minutos después (ya que por la deshidratación mis vías estaban complicadas en ese momento de cateterizar), presenté múltiples petequias en el brazo, ¡sorpresa! Prueba de Rumple Leede positiva.
Recordando las clases de semiología de Medicina Interna, esta prueba llamada también “del lazo” o “prueba del torniquete”, evalúa mecánicamente la fragilidad capilar, principalmente utilizada para realizar diagnóstico diferencial para enfermedades como el dengue y otros trastornos hemorrágicos. Consiste en someter el antebrazo del paciente a una presión intermedia entre la sistólica y la diastólica durante 5 minutos. Tras la retirada del manguito de presión y esperar a que la piel recupere su estado relajado se observa la zona presionada. El conteo de petequias producidas por la rotura capilar en un área de unos 10 cm2 superior a 30 da positivo en el signo de Rumpel-Leede. 1
Entraba entonces esta enfermedad como diferencial de COVID-19, ahora bien, anteriormente Joob y col. reportaron en la Journal American Academy of Dermatology (JAAD), que pacientes con COVID-19 pueden presentar un rash eritematoso similar al presente en infección por dengue. 2 En otra carta al Editor, los mismos autores comparten su experiencia en Tailandia, el segundo país en el que se produjo la infección por COVID-19 desde principios de enero de 2020. Para el 5 de marzo de 2020, fecha en la que se redactó ese artículo, habían solo 48 casos acumulados de COVID-19 en Tailandia, de ellos tan solo 1 paciente (2%) presentó una erupción cutánea con petequias. Debido a que el dengue es endémico en dicho país, la erupción petequial es un hallazgo clínico común, aunado al hecho que este paciente también presentó trombocitopenia, siendo mal diagnosticado con fiebre dengue. Los autores no fotografiaron ni realizaron biopsia de piel porque ésta no es una práctica de rutina de acuerdo con las pautas de práctica clínica del dengue en su entorno tropical, además que esta entidad se diagnóstica principalmente con la clínica. Posteriormente el paciente presentó insuficiencia respiratoria y fue remitido al centro médico terciario en donde se le practicó al paciente pruebas de laboratorio para descarte de otras infecciones virales comunes que podrían causar fiebre, erupción cutánea y problemas respiratorios, siendo lo único positivo el PCR-TR (Reacción en cadena de la polimerasa en tiempo real) que confirmó el diagnóstico final de la infección por COVID-19. 2
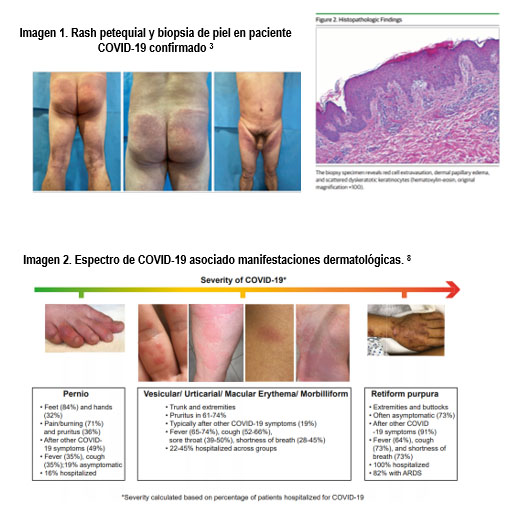
Más recientemente en julio de este año, Diaz-Guimaraens y col. publicaron un segundo caso de un paciente 48 años de edad, en Madrid que acudió por fiebre, dolor torácico tipo pleurítico y disnea a moderados esfuerzos. Refiere la aparición abrupta de lesiones discretamente pruriginosas que al examen físico se reportaron como máculas eritematosas, confluentes, con pápulas y petequias distribuidas simétricamente en pliegues flexurales de: glúteos, fosas poplíteas, muslos y abdomen; sin lesiones acrales o en mucosas. En los laboratorios de ingreso presentó: linfopenia sin trombocitopenia, PCR y dímero D elevado. Se le practicaron serologías virales todas negativas, siendo la PCR-TR para SARS-CoV- 2 positiva. Practicaron biopsia de piel por sacabocado que reveló: paraqueratosis focal con células disqueratóticas, dermatitis perivascular superficial con infiltrado linfocítico con abundante extravasación de glóbulos rojos y edema. No se evidenció vasculopatía o trombos intraluminales. Fue tratatado tópicamente con esteroides de alta potencia (dipropionato de betametasona 0.05%) BID y Loratadina 10mg OD. Además recibió hidroxicloroquina y azitromicina. Las lesiones cutáneas resolvieron a los 5 días. 3 (ver imagen 1)
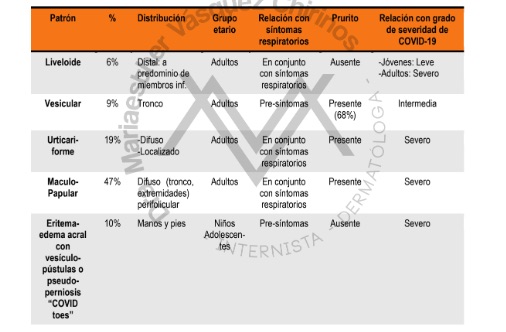
Teniendo en cuenta estos 2 reportes de casos, no descartaba la posibilidad de que fuera COVID-19, sin embargo el rash exantemático petequial antes descrito no estuvo asociado a maniobras de valsaba, ni fue provocado mecánicamente, sino que aparecieron espontáneamente. Vale la pena también recordar que estos han sido los únicos reportes aislados; en el estudio COVID y Piel desarrollado por dermatólogos en España, este exantema no fue descrito en ninguno de sus 5 patrones, a recordar: patrón urticariforme, maculo-papular, liveloide, vesicular y tipo pseudoperniosis. 4
Ante estos hallazgos semiológicos, al cuarto día me realicé exámenes de laboratorios que reportaron una franca leucopenia, con linfocitosis y trombocitopenia en 92.000 plaquetas. Química sanguínea con elevación de transaminasas 5 veces su valor normal. Tiempos de coagulación y reactantes de fase agua dentro de la normalidad, donde incluí: LDH, ferritina, PCR, VSG y CK, como lo descrito en los protocolos internacionales como perfil pronóstico de evolución de la enfermedad.
Al quinto día y siguiendo con la historia natural de la enfermedad, comencé a presentar un rash eritemato-morbiliforme a predominio de abdomen y extremidades superiores, que conforme evolucionaba se asoció a prurito de leve a moderada intensidad. No presenté lesiones en palmas ni plantas. Los episodios febriles se espaciaron hasta solo necesitar una dosis de acetaminofén matutino porque amanecía con cefalea holocraneana de moderada intensidad.
Teniendo una semana de haber iniciado los síntomas, me realicé serologías para dengue IgG e IgM, las cuales fueron positivas y de igual forma llegó el resultado de la PCR para SARS-CoV-2 la cual fue negativa, tanto la mía como la de mi hermano. Paralelamente presente rash macular eritemato-pruriginoso a predominio de abdomen, cara anterior de brazos y muslos. El prurito exacerba al momento del baño con agua templada. Solo apliqué emolientes en varias oportunidades.
Al décimo día la sintomatología había desaparecido, incluyendo la cutánea. Solo persistió por 72 horas más cefalea temporo-parietal de leve a moderada intensidad.
Realizando una evaluación en retrospectiva y recordando las palabras de uno de mis maestros del postgrado “en retrospectiva todo es más fácil y sencillo”, me detuve a analizar los acontecimientos sucedidos: presenté fiebre de patrón contínuo siempre acompañado de mialgias de fuerte intensidad a predominio de miembros inferiores, no tuve anosmia, ni disgeusia, no presenté descenso de la saturación de oxígeno en aire ambiente ni clínica o signos de insuficiencia respiratoria. Presenté rash morbiliforme en tronco y extremidades superiores así como petequias en regiones malares posterior a valsaba, así como prueba de Rumpel Leede. Mis laboratorios arrojaron una leucopenia franca con linfocitosis, trombocitopenia (sin manifestaciones de sangrado activo) y elevación de transaminasas. Por otro lado, el aspecto epidemiológico, es cierto que tenía la sospecha de que mi hermano fuera positivo asintomático, pero ¿que no hubiera desarrollado ningún síntoma? Sabiendo que es un virus con alta tasa de contagio, era muy poco probable, en vista de la alta carga viral a la que está sometido. Pero en conclusión, diagnóstico definitivo: Síndrome Febril Agudo de etiología viral: Dengue sin manifestaciones de sangrado (resuelto).
El origen del término dengue viene de la frase de la lengua swahili «Kadinga pepo», que describe esa enfermedad como provocada por un “fantasma”; la palabra swahili «dinga», del castellano «dengue», trata de describir las molestias del paciente por las artralgias. De las enfermedades transmitidas por artrópodos, aquellas causadas por el virus dengue se consideran las más importantes en cuanto a morbilidad y a mortalidad. El virus dengue pertenece a la familia Flaviviridae y al género Flavivirus, con cuatro serotipos antigénicamente diferentes, DENV-1 a DENV-4, todos capaces de producir varios tipos de enfermedad en el humano, conocidos comúnmente como “dengue”. Este término incluye tanto las formas no aparentes o silentes de la enfermedad como las formas clínicas severas y no severas. 5
Después de 2-15 días tras la picadura del mosquito infectado aparece de forma súbita fiebre alta, cefalea, dolor de espalda, dolor retroorbitario, dolor óseo y articular, debilidad, depresión y malestar. Se acompaña de exantema escarlatiniforme o morbiliforme en tórax y superficies flexoras. Al 4º día, tras una breve remisión, puede aparecer un exantema más evidente petequial o purpúrico, en tórax, tronco y extremidades. En 1-15% se desarrolla una fiebre hemorrágica. El exantema característico del dengue ocurre en aproximadamente el 50% de los pacientes. En el diagnóstico diferencial del eritema presente en el dengue, hay que considerar a: fiebre chikungunya, fiebre por mosca de la arena, fiebre escarlatina, síndrome de shock tóxico, enfermedad de Kawasaki y eritema infeccioso. La erupción morbiliforme en pacientes febriles con dengue hay que considerar otros los diagnósticos diferenciales como: mononucleosis infecciosa, roseola infantil, sarampión, rubéola, enterovirus, sífilis secundaria, fiebre tifoidea, fiebre chikungunya, virus del Nilo, fiebre O´nyong-nyong, virus Mayaro, virus de la mosca de la arena, enfermedad río Ross, leptospirosis, VIH y y ahora en la actualidad, COVID-19. 5
Y es que la asociación o la búsqueda de signos y síntomas que diferencien a COVID-19 y dengue cada vez son más necesarias, sobre todo en países tropicales como el nuestro. Ya en Perú esta problemática fue planteada por Saavedra-Velasco y col. 6 quienes plantean que hay siempre que considerar que el Dengue y COVID-19 presentan una gran similitud con relación a los eventos fisiopatológicos, así como signos y síntomas, incluyendo a la erupción máculo-papular característica del Dengue ya reportado en casos de pacientes con COVID-19. 2 Sin embargo, el problema se incrementa debido a que la infección por COVID-19 puede llevar a falsos positivos en las pruebas de cribado para Dengue, conllevando a un retraso en el diagnóstico de la infección por COVID-19 y a una mayor diseminación del virus, debido a que en la mayor parte de los casos de Dengue no se presentan signos de alarma y el control es ambulatorio. 6 Además, el equipo de salud que recibe a estos pacientes no utiliza habitualmente el Equipo de protección personal (EPP) adecuado, debido a que el virus del Dengue no se transmite por vía respiratoria. Sumado a ello, algunos virus como el COVID-19 y el Dengue pueden desencadenar una linfohistiocitosis hemofagocítica secundaria, llevando a los pacientes a presentar shock hipovolémico, vasoplejía y colapso cardiopulmonar debido a la hiperinflamación e hiperactivación del sistema inmunológico. Un claro ejemplo de lo antes mencionado es lo sucedido en febrero en Tailandia donde se confirmaron 35 casos de COVID-19; entre los que reportó un caso de un paciente que presentó la coinfección entre estos dos virus, con un desenlace fatal. 7 Si bien en Sudámerica aún no se presentan casos de coinfección entre Dengue y COVID-19, resulta fundamental tener en cuenta la posibilidad de tener casos similares en el futuro a fin de establecer protocolos y guías de atención clínica para el abordaje de estos pacientes.
Y, ¿qué hay de nuevo en COVID-19 y piel?
Recientemente la JAAD autorizó la publicación de un estudio basado en el espectro de COVID-19 asociado manifestaciones dermatológicas, de un registro internacional de 716 pacientes de 31 países, cuyo objetivo fue el de caracterizar las manifestaciones cutáneas representativas a nivel internacional de casos COVID-19 confirmado / sospechado e identificar dichas manifestaciones que pudieran proporcionar conocimiento de la fisiopatología y el curso de la enfermedad. De esta muestra, solo 171 pacientes (23%) presentaron clínica en piel: rash morbiliforme (22%), similar al pernio (18%), urticaria (16%), eritema macular (13%), púrpura vesicular (11%), papuloescamosa (9,9%) y livedo reticularis (6,4%). Las lesiones de tipo Pernio eran comunes en pacientes con enfermedad leve, mientras que la púrpura liveloide se presentó exclusivamente en pacientes enfermos hospitalizados. 8 (ver imagen 2)
La prevalencia de lesiones en piel de esta pandemia varia de un 2 a 20%, dependiendo del estudio, sin embargo actualmente ha sido difícil de establecer una más certera a nivel mundial. 9 Es por ello que Ortega-Quijano y col. publicaron recientemente en la JAAD un algoritmo para clasificar los rashes producidos en COVID-19. Los autores plantean que cuando se examinan pacientes con exantema generalizado por este virus, el primer paso debe ser buscar la presencia de vesículas o erosiones secundarias con costras. Si lo anterior está ausente, se puede observar palidez a la dígito-presión, presionando firmemente el área afectada durante varios segundos. Los rashes generalizados que no blanquean, compuestas por pequeñas máculas rojas, son indicativas de una erupción con petequias. Un distribución acral de las lesiones violáceas que no blanquean es indicativa de isquemia acral. Un componente vascular reticulado indicará el subtipo de livedo reticularis. Para las erupciones que blanquean o se tornan pálidas con la presión, el siguiente paso de este algoritmo es rascar la piel. El dermografismo se manifestaría como placas lineales en los sitios de rascado e indicaría el diagnóstico de erupción urticariforme, mientras que su ausencia indica erupción eritematosa. 10 (ver imagen 3).
Según datos preexistentes, podemos especular que las manifestaciones cutáneas en COVID-19 pueden presentarse en 2 grupos principales con respecto a su mecanismos fisiopatológicos: (1) características clínicas similares a exantemas virales, una respuesta inmune a virus nucleótidos; y (2) erupciones cutáneas secundaria a las consecuencias sistémicas causadas por COVID-19, especialmente vasculitis y trombosis. A parte de lo mencionado anteriormente, los pacientes con COVID-19 tienen más probabilidades de tener un mayor riesgo de reacciones adversas a medicamentos e interacciones de su tratamiento causando secundariamente reacciones cutáneas en cualquier momento durante el curso de la enfermedad. Por tanto, identificar pistas que apoyan una causa viral o la erupción de un fármaco es esencial.
Esto correspondería a los 5 patrones ya conocidos. 4 Sin embargo hay nuevos reportes de casos con nuevas manifestaciones en piel y pelo. Kalner y col describieron 2 pacientes con eritema periorbitario y Elhag y col. reportaron 1 caso de angioedema con urticaria en otro paciente. 11 Por otro lado Vañó-Galván, Shapiro J y col. reportaron el signo de “Gabrin”, en honor y memoria del Dr. Frank Gabrin, primer médico americano en fallecer por COVID-19, planteado que en el 67% de los pacientes hospitalizados por el nuevo coronavirus presentaron alopecia androgenética, apoyando la hipotésis de la asociación entre SARS-CoV-2 y la vía de los andrógenos, descrita previamente. 12 La vulnerabilidad del SARS-CoV-2 mediada por andrógenos puede ayudar a explicar la tasa de mortalidad desproporcionada entre los hombres y plantean que no es descabellado estudiar el efecto de los tratamientos sistémicos antiandrógenos dentro del protocolo para combatir la enfermedad. 13
En resumen, si las lesiones cutáneas en pacientes con COVID-19 están relacionados con los restos del virus es incierto. Los dermatólogos debemos tener en cuenta que las erupciones cutáneas que ocurren en pacientes con COVID-19 podría resultar de infecciones virales, consecuencias sistémicas o medicamentos recetados. El reconocimiento temprano de signos cutáneos que se asocian con complicaciones severas y el manejo oportuno son esenciales para mejorar los resultados de los pacientes. Por otro lado nunca debemos dejar de realizar diagnósticos diferenciales, apoyándonos no solamente de la semiología, sino de la epidemiología y el curso natural de la enfermedad que nos permita distinguir, como lo fue en mi caso, la sospecha de COVID-19 vs dengue, recordando que ésta última nunca ha dejado de ser endémica en nuestro país.
Por último quería explicarles la foto de la portada que es una moneda de oro con la cara de Albert Einstein, la más pequeña producida por el Banco de Suiza, circulando por primera vez este año y para recordarles que no todo lo que brilla en la piel con fiebre, es COVID-19, tenga siempre diagnósticos diferenciales, como lo fue en mi caso, exantema viral por dengue.
Por Mariaesther Vásquez Chirinos
Bibliografía
1.- Alfaro, A., Guardia, M. Utilidad de la prueba de torniquete como criterio para hospitalizar pacientes con dengue. Acta Med Costarr. 2004;46:22-23.
2.- Joob B, Wiwanitkit V, COVID-19 can present with a rash and be mistaken for Dengue. J Acad Dermatol. 2020. Pre-poof. Doi: 10.1016/ j.jaad.2020.03.036.
3.- Díaz-Guimaraens B, Dominguez-Santas M, Suarez-Valle A, Pindado-Ortega C et al. Petechial Skin Rash Associated With Severe Acute Respiratory Syndrome Coronavirus 2 Infection. JAMA. 2020;156:733-734.
4.- C Galvá, Catalá A, Carretero G, P. Rodríguez-Jiménez et al. Classification of the cutaneous manifestations of COVID-19: a rapid prospective nationwide consensus study in Spain with 375 cases: Atlas. Br J Dermatol. 2020. Doi: 10.1111/bjd.19163
5.- Escalante-Jibaja E, Escalante-Jijaba E, Del Catillo-Cabrera S, Delgado-Reque J. Exantemas virales. Dermatol Peru. 2018;28:167-184.
6.- Saavedra-Velasco M, Chiara-Chilet C, Pichardo-Rodríguez R, Grandez-Urbina A et al. Coinfección entre Dengue y COVID-19: necesidad de abordaje en zonas endémicas. Rev Fac Cs Med Córdoba. 2020;77:52-54.
7.- Promchertchoo P. Man diagnosed with dengue, COVID-19 dies in Thailand. Disponible en:
https://www.channelnewsasia.com/news/asia/thailand-records-firstcovid-19-death-coronavirus-12487738
8.- Freeman E, McMahon D, Lipoff J, Rosenbach M et al. The spectrum of COVID-19 associated
dermatologic manifestations: An international registry of 716 patients from 31 countries. J Am Acad Dermatol. 2020. Article in press. Doi: 10.1016/j.jaad.2020.06.1016
9.- Suchonwanit P, Leerunyakul K, Kositkuljorn C. Cutaneous manifestations in COVID-19: Lessons learned from current evidence. J Am Acad Dermatol. 2020. Article in press.
Doi: 10.1016/j.jaad.2020.04.094
10.- Ortega-Quijano D, Jiménez-Cauhe J, Selda-Enriquez G, Fernandez-Guarino M et al. Algorithm for the classification of COVID-9 rashes. J Am Acad Dermatol. 2020. Article in press.
Doi: 10.1016/j.jaad.2020.05.034
11.- Kalner S, Vergilis I. Periorbital erythema as a presenting sign of COVID-19. J Am Acad Dermatol. 2020. Article in press. 10.1016/j.jdcr.2020.05.001
12.- Wambier C, Vañó-Galván S, McCoy J, Shapiro J et al. Androgenetic alopecia present in the majority of patients hospitalized with COVID-19: The “Gabrin sign”. J Am Acad Dermatol. 2020;83-680-682. Doi: 10.1016/j.jaad.2020.05.079
13.- Elhag S, Ibrahim H. Angioedema and urticaria in a COVID-19 patient: A case report and review of the literature. J Am Acad Dermatol. 2020. Article in press. Doi: 10.1016/j.jdcr.2020.07.042
Anexos


 PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998








 El dia 11 de enero
El dia 11 de enero 


 Ricardo Perez Alfonzo Profesor, Cátedra de Dermatología. Escuela José María Vargas. UCV. Ex Presidente Sociedad Venezolana de Dermatología. Director Curso de Post-grado de Dermatología. Instituto de Biomedicina Dr. Jacinto Convit. UCV. Coordinador Consulta de Lupus Eritematoso Cutáneo. Hospital Vargas. Secretario General Colegio Ibero Latino Americano de Dermatología. Caracas Venezuela
Ricardo Perez Alfonzo Profesor, Cátedra de Dermatología. Escuela José María Vargas. UCV. Ex Presidente Sociedad Venezolana de Dermatología. Director Curso de Post-grado de Dermatología. Instituto de Biomedicina Dr. Jacinto Convit. UCV. Coordinador Consulta de Lupus Eritematoso Cutáneo. Hospital Vargas. Secretario General Colegio Ibero Latino Americano de Dermatología. Caracas Venezuela

















 El doctor José Cabrera, que explica el en un libro los detalles del virus, dice que el Carlos III no tiene cualificación para nivel cuatro
El doctor José Cabrera, que explica el en un libro los detalles del virus, dice que el Carlos III no tiene cualificación para nivel cuatro