Retinoides (acitretina, alitrenioina, isotretinoina): Actualización de las medidas para evitar la exposición durante el embarazo y de las advertencias sobre efectos neuropsiquiátricos.
Ampliar »Juan Antonio Chassaigne
La FDA aprueba un nuevo medicamento para el eccema
La FDA aprobó el Dupixent (dupilumab) en forma de inyección para el tratamiento de adultos que padecen eccema (dermatitis atópica) de moderada a severa
Ampliar »FDA: Penfigoide bulloso por inhibidores de DPP-4
Se han modificado los prospectos de fármacos con alogliptina, linagliptina, saxagliptina y sitagliptina para agregar este efecto adverso que puede requerir tratamiento inmunosupresor y eventual hospitalización
Ampliar »Riesgo de efectos secundarios graves por interacción entre anticoagulantes cumarínicos y miconazol
CIMUN. Blog de noticias del Centro de Información de Medicamentos de la Universidad Nacional de Colombia http://cimuncol.blogspot.com.co/2016/11/riesgo-de-efectos-secundarios-graves.html La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) del Reino Unido, a la vista de los informes de eventos hemorrágicos graves en pacientes consumidores de warfarina y miconazol, consideró tomar nuevas …
Ampliar »Vacunas y virus
Vacunas que se administran rutinariamente a los niños
Ampliar »Comunidcado de FDA
La FDA emite la regla definitiva sobre la seguridad y la eficacia de los jabones antibacterianos
Ampliar »Farmacología: Revisión de Cochrane
(Evidently Cochrane) Antibióticos y antisépticos en heridas: evidencias e ignorancia
Ampliar »Candida auris: UN HONGO PATÓGENO EMERGENTE
A principios de la semana pasada, el CDC emitió una alerta sobre Candida auris
Ampliar »Nota de la FDA sobre fluconazol y embarazo
La FDA revisará el estudio que examina el uso de fluconazol por vía oral (Diflucan) en el embarazo
Ampliar »Nota de Seguridad de la AEMPS: Jeringas de gel con marcado CE falso
Productos sanitarios. marcado CE falso.
Ampliar »La FDA aprueba la Matriz de Regeneración Dérmica Integra Omnigraft para tratar las úlceras del pie diabético
Comunicado de Prensa de la FDA
Ampliar »Riesgo de pustulosis exantemática aguda generalizada asociado al clopidogrel
El Centro de Información de Medicamentos de la Universidad Nacional de Colombia (CIMUNCOL) en fecha 5 de noviembre de este año presenta una nota de alerta relacionada con la incidencia de Pustulosis Exantematica Generalizada Aguda (PEGA) producida por el antiagregante plaquetario Clopidogrel. A continuación el comunicado: Clic aqui para leer …
Ampliar »FDA: No utilice productos inyectables para aclarar la piel. No están aprobados
Comparto con Ustedes una alerta de la FDA y productos inyectables blanqueadores, clic en el siguiente vínculo para leer: Productos inyectables para aclarar la piel: lo que debe saber
Ampliar »Comunicado de la MHRA sobre Ketoprofeno tópico y riesgos de reacciones de fotosensibilización
comunicado de la Agencia reguladora de medicamentos y productos sanitarios del Reino Unido (MHRA) sobre Ketoprofeno tópico y riesgos de reacciones de fotosensibilización Archivo adjunto:
Ampliar »Reacciones cutáneas graves por Panitumumab
Con base en la información del Instituto Nacional de Vigilancia de Medicamentos y Alimentos de Colombia (INVIMA) y las recomendaciones publicadas por parte de la agencia sanitaria Canadiense (Health Canadá), con respecto al riesgo de toxicidad dermatológica como Síndrome de Steven Johnson, necrolisis epidérmica tóxica y fascitis necrotizante tras la …
Ampliar »Simvastatina y vitiligo
El vitiligo es una enfermedad autoinmune inestética de la piel con gran deterioro de la calidad de vida del paciente afectado. No existe ningún tratamiento aprobado por la FDA y los tratamientos off label generalmente son costosos, requieren de mucho tiempo y constancia del paciente con resultados poco eficaces. Recientemente, …
Ampliar »Instituto Nacional de Higiene: Venta no autorizada de Medicamentos por red social Instagram
Alerta de Especialidad Farmacéutica Nº 004/2014 Fecha de publicación: 20/10/2014 [gview file=»https://piel-l.org/blog/wp-content/uploads//2014/12/Alerta-Belara-INH.pdf»]
Ampliar »APROBADO POR LA FDA el APREMILAST (Otelza) para la psoriasis en placas
The US Food and Drug Administration (FDA) has approved apremilast (Otezla, Celgene) for treating patients with moderate-to-severe plaque psoriasis who are candidates for phototherapy or systemic therapy, the manufacturer announced today.
Ampliar »FDA advierte sobre reacciones poco frecuentes pero serias de hipersensibilidad a ciertos productos para el acné de uso tópico y venta libre
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA por su sigla en inglés) emitió un comunicado el 25 de junio de 2014 acerca de ciertos productos para el acné de uso tópico y venta libre que pueden causar irritación severa o reacciones alérgicas poco frecuentes pero serias …
Ampliar »La EMA inicia una revisión de seguridad de los medicamentos que contienen hidroxizina
Invito a leer el archivo adjunto:
Ampliar »Omalizumab en el tratamiento de la urticaria crónica
Omalizumab es un anticuerpo monoclonal anti-IgE únicamente aprobado para su uso en el asma grave refractaria. En los últimos años han sido publicados un gran número de casos clínicos de urticaria crónica de difícil manejo terapéutico que han respondido de forma adecuada al tratamiento con omalizumab.
Ampliar »Nueva Interacción entre Ácido Micofenólico e Inhibidores de la Bomba de Protones
Los inhibidores de la bomba de protones pueden disminuir la eficacia del ácido micofenólico al alterar su absorción por modificación del pH. Este efecto no se ha observado con los comprimidos de ácido micofenólico gastrorresistentes.
Ampliar »ANMAT suspende comercialización de dermaglós protector solar FPS 70
Nota de la ANMAT (Argentina)
Ampliar »Ketoconazol De Administración Sistémica (comprimidos): Suspensión De Comercialización
Agencia Española de Medicamentos y Productos Sanitarios AEMPSNota informativa
Ampliar »Corticoides tópicos durante la gestación
El uso de corticoides tópicos durante la gestación no parece aumentar el riesgo de resultados adversos, pero a dosis altas se podría asociar a bajo peso al nacer, según un estudio retrospectivo de cohortes (JAMA Dermatol 2013; 4 septiembre).
Ampliar »FDA Puts Strict Limits on Oral Ketoconazole Use
By John Gever, Deputy Managing Editor, MedPage Today
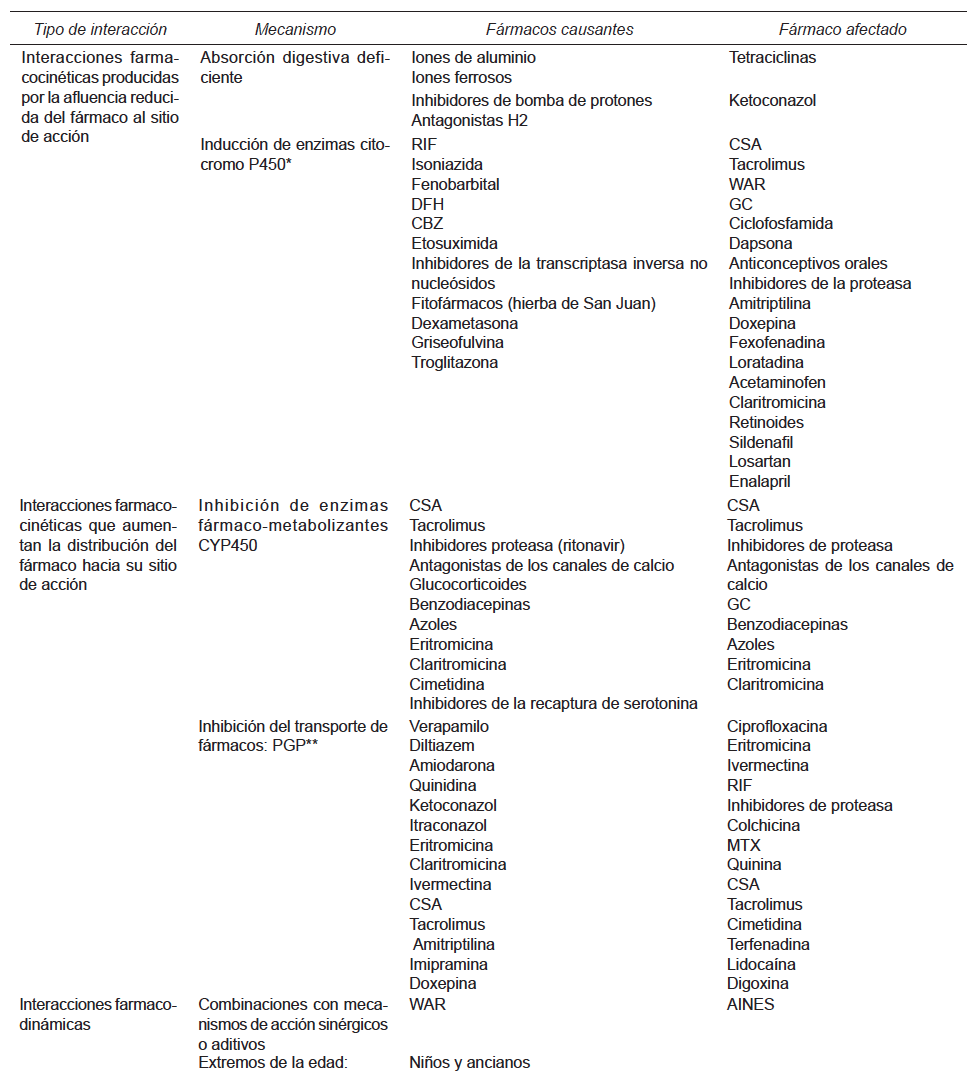
Ampliar »Interacciones, contraindicaciones y precauciones de uso de los medicamentos anti TNF
Interacciones de fármacos en dermatología
Se denomina interacción farmacológica a la acción que un fármaco ejerce sobre otro, de modo que éste experimente un cambio cuantitativo o cualitativo en sus efectos. En toda interacción hay, pues, un fármaco cuya acción es modificada (fármaco interferido) y otro u otros que actúan como precipitantes o desencadenantes de …
Ampliar »Drogas antihipertensivas y cáncer de labio
Se sabe que hidroclorotiacida y nifedipina son fotosensibilizantes. En este estudio de casos y controles realizado en población protegida en la Mutua Kaiser Permanente North California, en el período 1994-2008 se identificaron 712 casos de cáncer de labio (casos) y 22.904 controles emparejados por edad, sexo y año de entrada …
Ampliar »Reacciones cutáneas graves por tetracepam
La notificación de reacciones cutáneas graves en pacientes tratados con tetracepam (Myolastan®) ha motivado que la Agencia Europea de Medicamentos (EMA) revise los datos sobre su seguridad (EMA, 10 de enero de 2013).
Ampliar »Atención en la clasificación de la FDA de drogas riesgosas en embarazo
Según un reciente estudio publicado por Dermatology Online Journal, la categoría B -administración segura en embarazo- puede contener fármacos no suficientemente probados en humanos, en comparación a otros métodos
Ampliar »Panitumumab (Vectibix): Riesgo de fascitis necrotizante
Anónimo. Panitumumab (Vectibix): risk of necrotising fasciitis. Drug Safety Update 2012;6:S1. ID 93051 Panitumumab (Vectibix®) es un inhibidor del receptor del factor de crecimiento epidérmico utilizado en monoterapia y en combinación con oxaliplatino e irinotecán para el tratamiento del cáncer colorrectal metastásico con KRAS no mutado.
Ampliar »Metahemoglobinemia por EMLA crema
Utilización de emla® crema (lidocaína y prilocaína) sobre superficies extensas de piel: riesgo de Metahemoglobinemia
Ampliar »¿Cómo actúa el fármaco Vismodegib en la vía Hedgehog?
La vía de transducción de señales Hedgehog (Hh) consta de varios componentes: el receptor de membrana Ptch1 ("parchado") y la proteína transmembrana SMO (smothered homologue), así como los efectores Gli que son factores de transcripción.
Ampliar »Riesgo de tromboembolismo venoso y reacciones dermatológicas graves
Ranelato de estroncio (osseor®, protelos®): Riesgo de tromboembolismo venoso y reacciones dermatológicas graves. Nuevas contraindicaciones de uso.
Ampliar »Registro Desensibilización a Medicamentos Oncológicos
España se convierte en el primer país europeo en contar con un Registro de Desensibilización a Medicamentos Oncológicos. Este “primer y único” Registro Europeo de Desensibilización a Medicamentos Oncológicos ha sido puesto en marcha por la Sociedad Española de Alergología e Inmunología Clínica (SEAIC), y su creación se debe al aumento de las enfermedades oncológicas y la frecuencia de reacciones de hipersensibilidad por fármacos considerados arsenal de primera línea.
Ampliar »Relación beneficio-riesgo de la tigeciclina
La tigecilina (Tygacil) no se ha mostrado superior a los antibióticos estándar para el tratamiento de infecciones graves, según los resultados de un metanálisis reciente (Lancet Infect Dis 2011; 25 julio).
Ampliar »The National Institute for Health and Clinical Excellence (NICE) no recomienda el uso de Belimumab (Benlysta®) en el tratamiento del lupus.
The National Institute for Health and Clinical Excellence (NICE) has today (30 September) opened its public consultation on the use of belimumab (Benlysta) for treating systemic lupus erythematosus. In the draft guidance, NICE is provisionally unable to recommend belimumab for treating adult patients with active autoantibody-positive systemic lupus erythematosus, where …
Ampliar »Anti-TNF y riesgo de infección por Listeria y Legionella. Alerta de la FDA
La FDA alerta sobre el riesgo de infecciones con los inhibidores del factor de necrosis tumoral alfa (TNF-?) La FDA actualizó recientemente los recuadros negros en las etiquetas de los productos que contienen inhibidores del factor de necrosis tumoral alfa (TNF-?) (infliximab, etanercept, adalimumab, certolizumab y golimumab) incluyendo información sobre …
Ampliar »Incremento en el riesgo de cáncer de próstata con el uso de finasterida y dutasterida
La FDA notificó a la comunidad que modificará la etiqueta de los productos que contienen fármacos pertenecientes al grupo farmacológico de inhibidores de la 5-alfa-reductasa, para incluir nueva información sobre el incremento en el riesgo de cáncer de próstata asociado con su uso [1]. Los fármacos pertenecientes a este grupo …
Ampliar » PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998
PIEL-L Latinoamericana Publicacion periodica en dermatologia | Fundada en 1998